



業(yè)務咨詢
中國:
Email: marketing@medicilon.com.cn
業(yè)務咨詢專線:400-780-8018
(僅限服務咨詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




2015年8月18日,國務院公布了《國務院關于改革藥品醫(yī)療器械審評審批制度的意見》(國發(fā)〔2015〕44號),為解決藥品、醫(yī)療器械審評審批中存在的問題提出了若干意見,其中最受關注的意見有幾點:
1、提出了解決審批積壓的時間表。爭取2016年底前消化完積壓存量,盡快實現(xiàn)注冊申請和審評數(shù)量年度進出平衡,2018年實現(xiàn)按規(guī)定時限審批。
2、提高仿制藥的質量。加快仿制藥質量一致性評價,力爭2018年底前完成國家基本藥物口服制劑與參比制劑質量一致性評價。將仿制藥由現(xiàn)行的“仿已有國家標準的藥品”調(diào)整為“仿與原研藥品質量和療效一致的藥品”。
3、改變了新藥的定義。將新藥由現(xiàn)行的“未曾在中國境內(nèi)上市銷售的藥品”調(diào)整為“未在中國境內(nèi)外上市銷售的藥品”。根據(jù)物質基礎的原創(chuàng)性和新穎性,將新藥分為創(chuàng)新藥和改良型新藥。
4、開展藥品上市許可持有人制度試點。
由此可見,藥品審批部門要在時間表內(nèi)完成審批積壓的任務,大量藥品申請將會被退回。市場上供大于求的藥品、生產(chǎn)工藝落后的藥品、質量不符合規(guī)定的藥品、申報資料不完整的藥品,將會不獲批準。
另外,最受影響的是按現(xiàn)行《藥品注冊管理辦法》(局令第28號)化學藥注冊分類第3分類申請的藥品。按照新定義,這類藥品將被劃歸為仿制藥,對這些藥品在市場上的招標定價或有一定影響。
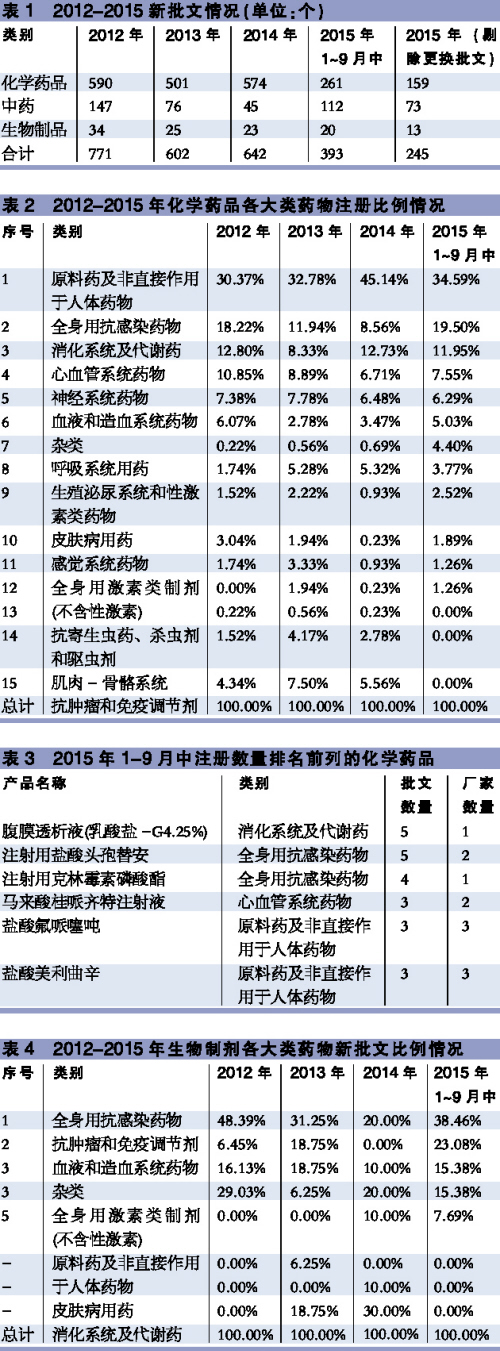
2015年1-9月中,國家食品藥品監(jiān)督管理總局共批出新批文245個,其中化學藥品批文159個,占比64、9%,中藥批文73個,占比29、8%,生物制品批文13個,占比5、3%(見表1)。近幾年新批文數(shù)量相對穩(wěn)定,預計在開始解決藥品審批積壓的行動后,新批文的數(shù)量或有一定增加。
新產(chǎn)品方面,中國醫(yī)學科學院醫(yī)學生物學研究所研制的Sabin株脊髓灰質炎滅活疫苗獲批上市,商品名“埃必維”。通過采用現(xiàn)行脊髓灰質炎減毒活疫苗的生產(chǎn)毒株(Sabin株),經(jīng)在Vero細胞生物反應器培養(yǎng)收獲病毒,結合滅活疫苗生產(chǎn)工藝制備而成。該疫苗主要通過注射途徑用于兒童預防脊髓灰質炎病毒的感染,它的上市將對我國徹底消滅脊髓灰質炎發(fā)揮至關重要的作用。注射用重組人TNK組織型纖溶酶原激活劑,商品名“銘復樂”,由廣州銘康生物工程有限公司研發(fā)。該產(chǎn)品采用基因重組技術生產(chǎn),臨床用于急性心梗的溶栓治療,是目前唯一可以單次靜脈推注的溶栓藥品種。長春金賽藥業(yè)的注射用重組人促卵泡激素,是首家國內(nèi)生產(chǎn)企業(yè)獲得生產(chǎn)批文。該品種之前只有德國默克的進口產(chǎn)品在國內(nèi)銷售。
 相關新聞
相關新聞