- 1913年,德國諾貝爾醫(yī)學(xué)獎獲得者Paul Ehrlich提出魔術(shù)子彈 (magic bullet) 的概念:將毒素(子彈頭)安裝在能精準瞄準癌細胞的載體上,從而實現(xiàn)不傷害正常細胞的前提下精準殺死癌細胞。這一設(shè)想在當時被認為是天方夜譚。1989年,美國杜蘭大學(xué)醫(yī)學(xué)院教授、諾貝爾獎獲得者Andrew v. Schaly教授首次將小分子抗腫瘤藥物溶肉瘤素(美法侖,Melphalan)和苯丁酸(Chlorambucil) 分別與多促黃體激素釋放激素(Luteinizing hormone-releasing hormone,LHRH) 連接,構(gòu)成新的LHRH受體靶向抗腫瘤復(fù)合物。2000年,F(xiàn)DA批準了輝瑞研發(fā)的ADC(Antibody Drug Conjugates)藥物Mylotarg?,將魔術(shù)子彈這一“天方夜譚”演繹成現(xiàn)實。
- PDC(peptide-drug conjugate),繼 ADC之后的又一個“黃金賽道”目前,全球已有16個ADC藥物獲批上市,7款A(yù)DC在中國獲批上市。盡管ADC取得了長足的發(fā)展,但作為細胞毒性藥物,ADC可能會產(chǎn)生嚴重的毒性阻礙其進一步的治療;ADC的復(fù)雜結(jié)構(gòu)導(dǎo)致生產(chǎn)成本高;ADC分子量較大限制了穿透實體腫瘤的能力,從而限制其療效。鑒于此,整合了多肽的優(yōu)勢的多肽偶聯(lián)藥物PDC(peptide-drug conjugate)乘勢而起,與ADC相比,PDC分子量更小,不易引起自身免疫反應(yīng);與抗體生產(chǎn)的復(fù)雜工藝過程相比,PDC更易合成與純化,有效降低大規(guī)模生產(chǎn)的成本,有望成為繼小分子藥物、單克隆抗體、ADC藥物之后新一代靶向抗癌藥物。
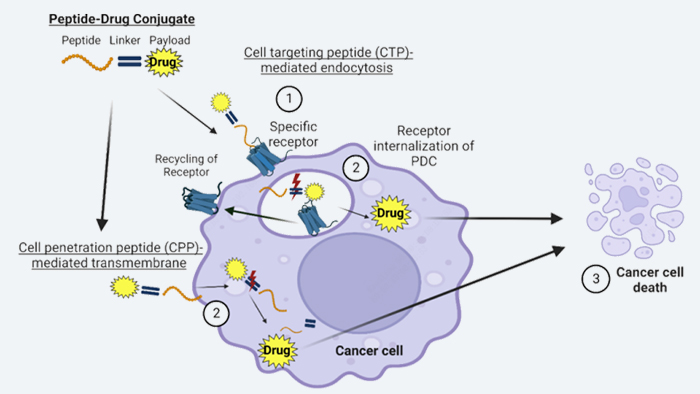 多肽偶聯(lián)藥物(PDC)作用機制
多肽偶聯(lián)藥物(PDC)作用機制
 美迪西多肽藥物研發(fā)服務(wù)內(nèi)容
美迪西多肽藥物研發(fā)服務(wù)內(nèi)容- 多肽創(chuàng)新藥物研發(fā)建立多肽藥物分子抗菌活性計算機預(yù)測模型;建立多肽類藥物靶向結(jié)合的分子模擬技術(shù)、輔助基于活性的分子快速優(yōu)化;擁有完善的創(chuàng)新藥物開發(fā)專業(yè)團隊,可助力新型多肽偶聯(lián)藥物(PDC)的研發(fā)。
- 多肽新劑型制劑研發(fā)美迪西擁有多肽藥物長效化新型制劑研發(fā)技術(shù),包括緩釋微球、緩釋凝膠、納米制劑等。
- 多肽仿制藥物研發(fā)完善的多肽類仿制藥研發(fā)體系,掌握各專業(yè)板塊的關(guān)鍵核心技術(shù);布局多肽類仿制藥的特色產(chǎn)品研發(fā)服務(wù)
 服務(wù)優(yōu)勢
服務(wù)優(yōu)勢- 豐富的多肽合成經(jīng)驗多肽的選擇會影響PDC中藥物內(nèi)吞作用的效率,一旦靶點被選擇,選擇合適的多肽也很重要。理想的PDC多肽應(yīng)具有較強的靶標結(jié)合親和力、高穩(wěn)定性、低免疫原性、高效內(nèi)化和較長的血漿半衰期。美迪西多肽合成研究團隊目前已建立了從上游非天然氨基酸結(jié)構(gòu)單元的合成、多肽藥物修飾和大規(guī)模合成,到下游多肽藥物信號轉(zhuǎn)導(dǎo)通路和作用機制研究的完善體系。通過化學(xué)、生物學(xué)、醫(yī)學(xué)、藥學(xué)等多學(xué)科合作與交叉,能更快響應(yīng)客戶需求,為PDC多肽的合成和選擇提供了技術(shù)保障。
- 成功的ADC藥物研發(fā)經(jīng)驗美迪西抗體藥物偶聯(lián)物(ADC)研發(fā)服務(wù)平臺可以為客戶提供ADC Payloads合成、ADC藥物偶聯(lián)、ADC藥效學(xué)評價、ADC藥代動力學(xué)評價和ADC安全性評價等服務(wù)。截至2023年末,美迪西已成功助力24個ADC藥物獲批臨床,并有20多個ADC項目在研。這些經(jīng)驗為PDC連接子的選擇提供堅實支撐。
- 高效的一站式研發(fā)服務(wù)美迪西已成功打造了全方位一體化的服務(wù)模式,不僅可將傳統(tǒng)研發(fā)環(huán)節(jié)(多肽、偶聯(lián)物、原料藥、制劑等)無縫銜接地串聯(lián),還可整合成并聯(lián)式的研發(fā)模式,呈現(xiàn)出嚴密計劃、高效協(xié)同、有序推進的服務(wù)優(yōu)勢,可更多、更快、更好、更省地賦能新藥研發(fā)。
 PDC研發(fā)關(guān)鍵技術(shù)
PDC研發(fā)關(guān)鍵技術(shù)- PDC是一種靶向治療藥物,其結(jié)構(gòu)和功能類似于ADC,由三個重要成分組成:靶向多肽(歸巢肽)、連接子和細胞毒素。三者協(xié)同作用,通過靶向腫瘤細胞的特定受體傳遞細胞毒素,這三個元素的選擇為技術(shù)關(guān)鍵。
 PDC藥物結(jié)構(gòu)示意圖
PDC藥物結(jié)構(gòu)示意圖 - 靶向多肽
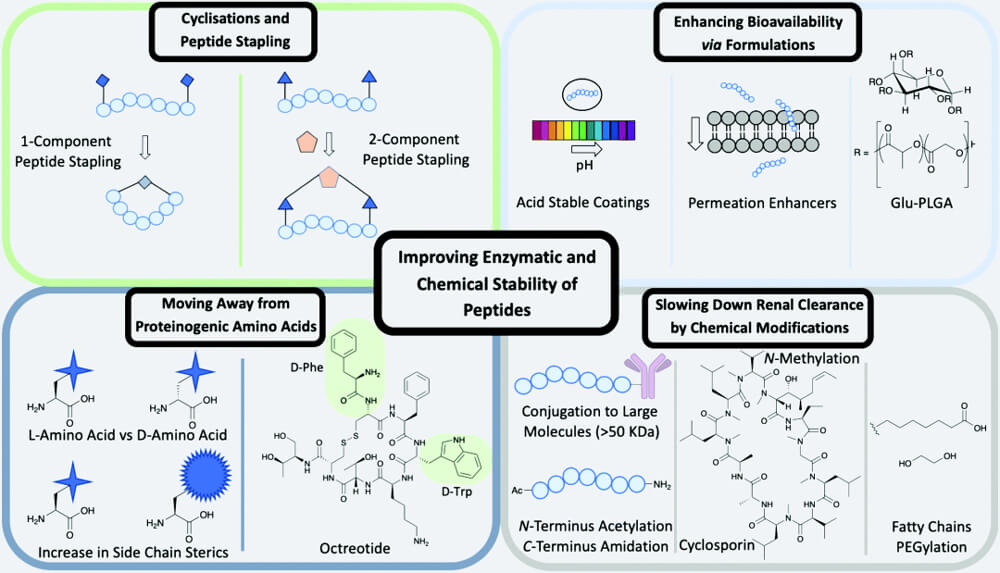 靶向多肽的優(yōu)化方式PDC 中使用的靶向多肽一般可以分為兩類: 細胞穿透肽(CPPs)和細胞靶向肽(CTPs)。CPPs 是具有跨膜運輸能力的短肽(少于 30 個殘基),可分為蛋白質(zhì)源性 CPPs、修飾CPPs和設(shè)計CPPs 三種類別。而CTPs 能夠與特定細胞內(nèi)過度表達的受體相互作用,一旦CTPs與治療藥物結(jié)合,就能轉(zhuǎn)運治療藥物并使之富集在目標位置,從而大大減少治療藥物的副作用。
靶向多肽的優(yōu)化方式PDC 中使用的靶向多肽一般可以分為兩類: 細胞穿透肽(CPPs)和細胞靶向肽(CTPs)。CPPs 是具有跨膜運輸能力的短肽(少于 30 個殘基),可分為蛋白質(zhì)源性 CPPs、修飾CPPs和設(shè)計CPPs 三種類別。而CTPs 能夠與特定細胞內(nèi)過度表達的受體相互作用,一旦CTPs與治療藥物結(jié)合,就能轉(zhuǎn)運治療藥物并使之富集在目標位置,從而大大減少治療藥物的副作用。 - Linker
Linker 類型 非裂解類 pH敏感類 氧化還原敏感類 酶敏感類 碳鏈 腙鍵 二硫鍵 Gly-Phe-Leu-Gly 酰胺鍵 烯醚鍵 Val-Cit(Cit-Citrulline) 醚鍵 縮醛鍵/縮酮鍵 Phe-Lys PDC中常見的Linker類型Linker 的選擇需要考慮到 PDC 所處的微環(huán)境,以免干擾肽與其受體的結(jié)合親和力和藥物功效。根據(jù)其長度、穩(wěn)定性、釋放機理、官能團、親/疏水性等特征,PDC中使用的 Linker 存在多種不同類型。 - 細胞毒素細胞毒素被當作“有毒彈頭”應(yīng)用在 PDC 中,未加修飾的原始細胞毒素如不與靶向肽結(jié)合,其將癌細胞與正常細胞區(qū)分開的能力較差,毒性不受控制的缺點暴露無遺。此外,細胞毒素還需要合適的載體以有效地交付給腫瘤組織去對抗其高疏水性,從而增強細胞毒劑的藥代動力學(xué)和治療窗口。
 圖:DAU柔紅霉素;DOX阿霉素;CPT喜樹堿;PTX紫杉醇;GEM吉西他濱(紅圈為最常見的偶聯(lián)位點)目前,代表性細胞毒素包括吉西他濱、阿霉素、柔紅霉素、紫杉醇、喜樹堿等。據(jù)Grand View Research報告,到2030年,全球多肽藥物結(jié)合物市場預(yù)計將達到26.7億美元,預(yù)測期間的復(fù)合增長率為18.58%。隨著更多創(chuàng)新方法的研究,未來將會出現(xiàn)更安全、更有效的腫瘤靶向PDC,在癌癥治療領(lǐng)域大放異彩,為難治性癌癥患者帶來希望,也帶來更大的市場機遇。創(chuàng)新力量不斷覺醒,下一波浪潮正在翻涌而來。美迪西期待與行業(yè)同仁攜手共進,馭勢圖新,為全球生物醫(yī)藥產(chǎn)業(yè)的穩(wěn)健發(fā)展貢獻力量。
圖:DAU柔紅霉素;DOX阿霉素;CPT喜樹堿;PTX紫杉醇;GEM吉西他濱(紅圈為最常見的偶聯(lián)位點)目前,代表性細胞毒素包括吉西他濱、阿霉素、柔紅霉素、紫杉醇、喜樹堿等。據(jù)Grand View Research報告,到2030年,全球多肽藥物結(jié)合物市場預(yù)計將達到26.7億美元,預(yù)測期間的復(fù)合增長率為18.58%。隨著更多創(chuàng)新方法的研究,未來將會出現(xiàn)更安全、更有效的腫瘤靶向PDC,在癌癥治療領(lǐng)域大放異彩,為難治性癌癥患者帶來希望,也帶來更大的市場機遇。創(chuàng)新力量不斷覺醒,下一波浪潮正在翻涌而來。美迪西期待與行業(yè)同仁攜手共進,馭勢圖新,為全球生物醫(yī)藥產(chǎn)業(yè)的穩(wěn)健發(fā)展貢獻力量。