PROTAC技術作用機制
PROTAC技術作用機制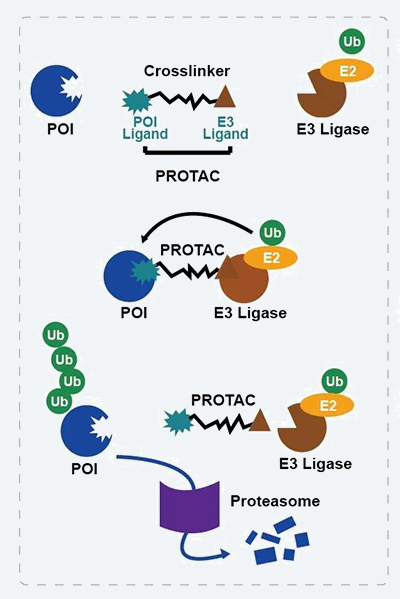
1.PROTAC分子通過其一端的靶蛋白配體(POI Ligand)特異性識別并結合靶蛋白,通過其另一端的E3泛素連接酶配體(E3 Ligase Ligand)特異性識別并結合E3 Ligase;
2.形成P O I - P R O T A C - E3 ligase三元復合體;
3. 在此三元復合體中,靶蛋白POI被E3 ligase泛素化修飾,泛素化修飾了的POI隨后被蛋白酶體識別并降解,由此抑制靶蛋白的功能。
 PROTAC技術優勢
PROTAC技術優勢- 改變靶點的“不可成藥性”(undruggable)PROTAC的作用分子機制是通過泛素-蛋白酶體系統降解靶蛋白,并非通過競爭結合以封閉靶蛋白功能區而發揮蛋白功能抑制作用,因此PROTAC對靶蛋白識別結合區不一定非得是活性區,結合力也不一定必須是高親和力;這使得一些缺乏高親和力小分子結合的“不可成藥性”靶蛋白變成“可成藥性”。
- 高效性傳統小分子抑制劑通過競爭結合靶蛋白活性功能域而抑制靶蛋白功能,所需小分子的量往往較大;而PROTAC通過泛素-蛋白酶體系統降解靶蛋白以解除靶蛋白功能,故具有可循環使用性、用量低和高效性的特點。
- 無免疫原性與抗體藥物相比,PROTAC不會引發抗藥抗體產生。
 美迪西PROTAC技術服務
美迪西PROTAC技術服務- PROTAC設計合成美迪西有著多年的PROTAC合成經驗,匯總了當前熱門的多種POI配體,不同組織類型的E3 Ligase配體,并且建立了含數百種連接分子的Linker庫。此外,美迪西成熟的計算機輔助藥物設計技術平臺,大大提高PROTAC的設計合成質量。美迪西已經驗證的PROTAC靶點有:IRAK4, AR, ER, IKZF1, IKZF2, IKZF3, BTK, EGFR, BRD4, BCL-xL, CDK4, CDK6, SMARCA2, SMARCA4, AKT, ALK, STAT3, SHP2, FGFR1, FGFR2, KRAS G12C, KRAS G12D等。
- PROTAC體外研究美迪西案例:HiBiT-標簽-POI 穩轉細胞株高通量篩選:利用基因敲入技術構建的“內源蛋白-HiBiT”穩轉株細胞,對PROTAC分子進行高通量篩選,計算DC50。
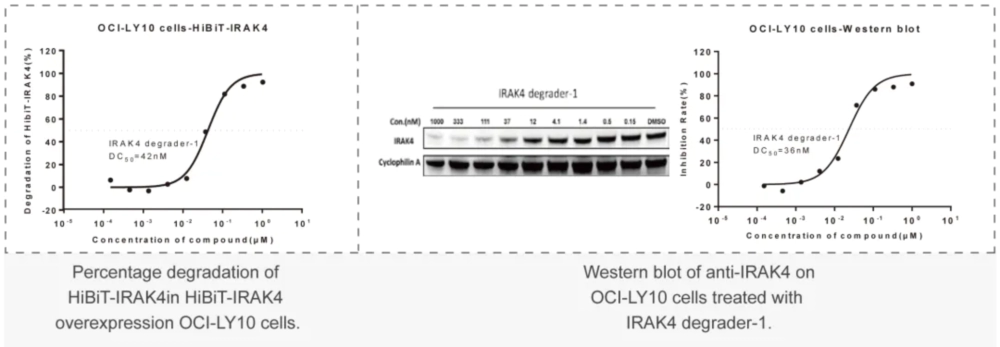 美迪西案例:Western Blot或者In-cell Western:通過WB實驗檢測初篩到的PROTAC分子對靶標蛋白的降解能力,分析DC50值。
美迪西案例:Western Blot或者In-cell Western:通過WB實驗檢測初篩到的PROTAC分子對靶標蛋白的降解能力,分析DC50值。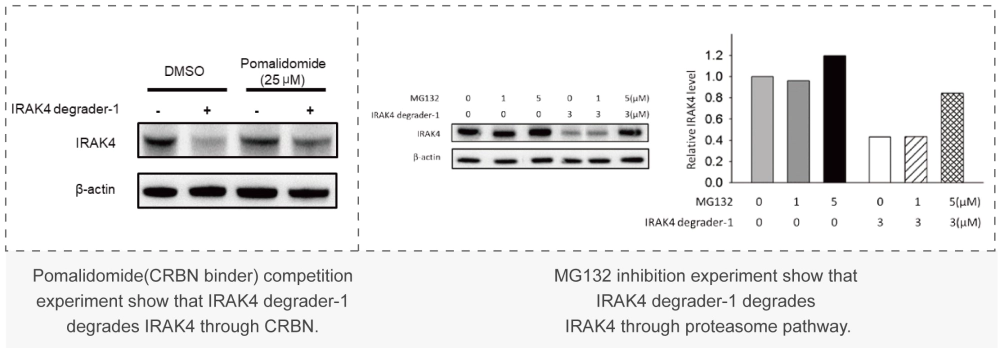 美迪西案例:細胞毒性實驗(CCK-8或CTG法):檢測上述篩選到PROTAC對癌細胞增殖抑制能力,分析IC50值。
美迪西案例:細胞毒性實驗(CCK-8或CTG法):檢測上述篩選到PROTAC對癌細胞增殖抑制能力,分析IC50值。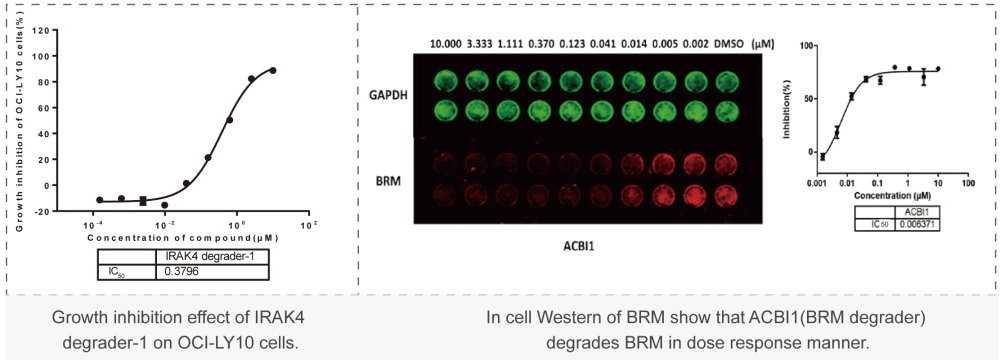
美迪西建立了完整的PROTAC體外分析平臺,其主要服務內容包括二元及三元復合物形成分析、靶點泛素化分析以及靶點降解水平分析。這些服務內容涵蓋了從蛋白水平到細胞水平的多種檢測方法,能夠為客戶提供全面且高效的PROTAC分子體外評價解決方案。
如果您對PROTAC體外分析技術感興趣,請立即聯系我們,獲取解決方案。
- PROTAC體內藥理藥效研究
美迪西藥理藥效部緊跟行業發展與市場需求,不斷完善創新,經過多年的經驗累積,多方驗證和長期實踐考驗,建立了完善的動物模型庫,可根據客戶的需求提供各種有效的動物模型,用來檢測藥物的有效性。實驗動物有非人靈長類動物、犬、大小鼠、兔、豚鼠、小型豬等種類。美迪西已建立440+種腫瘤評價模型,為多種創新療法賦能。
美迪西案例: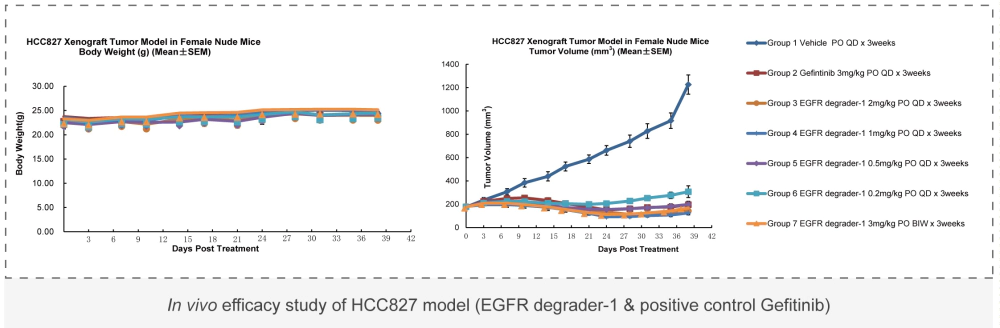
- PROTAC藥代動力學評價美迪西DMPK團隊,通過PROTAC技術原理,結合研發案例,利用完善的體外 ADME、體內PK測試平臺,在小分子化合物研究基礎上,建立起一套關于PROTAC藥物的篩選和IND評價體系,關注藥物的溶解度、滲透性、代謝穩定性、代謝產物鑒定與體內PK研究等,幫助客戶快速推進PROTAC藥物的研發。美迪西案例:下文中科研人員使用Thalidomide募集Cereblon/cullin 4A E3連接酶并通過 Linker進行固化,在小鼠中發現了具有良好口服藥代動力學特性的高效AR降解劑 ARD-2128。

在此項研究中,科研人員通過美迪西評估了五種高效AR降解劑在小鼠中靜脈和口服給藥的藥代動力學 (PK) 數據,其中最優化合物為ARD-2128。PK數據顯示,ARD-2128具有出色的整體PK曲線:低清除率 (1.2 mL/min/kg) 和中高穩態分布容積 (Vss為2.7 L/kg)。ARD-2128按2 mg/kg劑量靜脈給藥后的T1/2為27.6小時,按5 mg/kg劑量口服給藥后T1/2為18.8小時。ARD-2128 (5 mg/kg) 在小鼠體內達到67%的口服生物利用度,通過口服給藥有效降低AR蛋白并抑制腫瘤組織中的AR調節基因,從而有效抑制小鼠腫瘤生長且無毒性跡象。
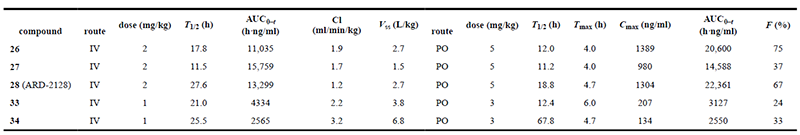 五種化合物在雄性 ICR 小鼠中的 PK 數據匯總[1]此外,科研人員通過美迪西測試了ARD-2128在小鼠、大鼠、犬、猴和人五種屬中的血漿穩定性。數據顯示ARD-2128在所有五種屬中都具有穩定的血漿穩定性。
五種化合物在雄性 ICR 小鼠中的 PK 數據匯總[1]此外,科研人員通過美迪西測試了ARD-2128在小鼠、大鼠、犬、猴和人五種屬中的血漿穩定性。數據顯示ARD-2128在所有五種屬中都具有穩定的血漿穩定性。 ARD-2128 在五種屬中的肝微粒體中代謝穩定性和血漿穩定性[1]
ARD-2128 在五種屬中的肝微粒體中代謝穩定性和血漿穩定性[1]
 總結
總結- 雖然擁有諸多優點,但PROTAC藥物開發仍然面臨許多技術難點。成藥性是其難點。同時,需要尋找更多可用的E3泛素連接酶及其結合物。此外,還需要考慮如何改善大規模生產方案,提高產率,從而降低成本。美迪西PROTAC藥物研發服務平臺不僅包含設計合成 PROTAC和進行PROTAC的體外活性研究,還能對PROTAC進行動物體內藥效檢測、藥代動力學研究和安全性評價等,并匯總實驗結果和材料進行 IND 申報,以助力客戶加快PROTAC藥物的研發進程。美迪西部分助力PROTAC項目案例——CG001419
2022年8月,睿躍生物(Cullgen)宣布用于治療晚期實體瘤的TRK降解劑(CG001419)新藥臨床研究(IND)申請獲批。CG001419是全球首創(First in class)的TRK (神經營養因子受體酪氨酸激酶)蛋白降解劑。CG001419作為全球首創的高選擇性強效口服靶向蛋白降解劑,其適應癥為用于治療治療NTRK基因融合、NTRK基因點突變和NTRK基因擴增或過表達晚期或轉移性成人實體瘤。作為睿躍生物的合作伙伴,美迪西為CG001419的研發提供了符合中、美GLP規范的(包括藥物代謝動力學研究和安全性評價在內的)綜合性臨床前研究服務,以合規、高效、高質的服務助力其成功獲批。GT919
2023年5月,標新生物分子膠降解劑管線1類新藥GT919膠囊獲得FDA批準進入臨床試驗,用于惡性血液腫瘤的治療。該管線此前已于2022年12月20日獲得國家藥品監督管理局(NMPA)批準開展臨床試驗,目前正在中國進行I期臨床研究。
對于GT919的研發,美迪西憑借扎實的研發實力,高效完成了其從藥物發現到臨床申報,包括藥物發現、藥學研究、臨床前研究等一站式臨床前研究服務。GT929
2023年10月,標新生物第二個分子膠降解劑管線1類新藥GT929膠囊獲得FDA批準進入臨床試驗,用于治療惡性血液腫瘤。該管線此前已于2023年7月獲得NMPA批準開展臨床試驗。GT929是一款靶向IKZF1/3靶點的分子膠,在彌漫大b細胞淋巴瘤動物模型中顯示了極佳的效果。
作為標新生物的戰略合作伙伴,美迪西為GT929的研發提供了制劑研究、臨床前研究(包括藥效、藥代、安評)以及撰寫中英文申報資料等服務,為GT929快速實現中美雙報雙批提供了技術保障!獲取更多服務案例,請聯系我們:
 推薦閱讀:
推薦閱讀:- 參考文獻:[1]. Xin Han, et al. Strategies toward Discovery of Potent and Orally Bioavailable ProteolysisTargeting Chimera Degraders of Androgen Receptor for the Treatment of ProstateCancer. J Med Chem. 2021 Sep9;64(17):12831-12854.
[2]. AyeshaA Shafi, et al. Androgen receptors in hormone-dependent and castration-resistantprostate cancer. PharmacolTher. 2013 Dec;140(3):223-38.
[3]. Weiguo Xiang, et al. Discovery of ARD-2585 as an Exceptionally Potent and Orally Active PROTACDegrader of Androgen Receptor for the Treatment of Advanced Prostate Cancer. J Med Chem. 2021 Sep 23;64(18):13487-13509.
[4]Si-Min Qi, et al. PROTAC: An Effective Targeted Protein Degradation Strategy for Cancer Therapy. Front Pharmacol. 2021 May 7;12:692574.
[5] Galen Andrew Collins, et al. The Logic of the 26S Proteasome. Cell. 2017 May 18;169(5):792-806.
[6]Madhusoodanan Mottamal, et al. From Pure Antagonists to Pure Degraders of the Estrogen Receptor: Evolving Strategies for the Same Target. ACS Omega. 2021 Mar 30;6(14):9334-9343.
[7]Jared A M Bard,et al. Structure and Function of the 26S Proteasome. Annu Rev Biochem. 2018 Jun 20;87:697-724.[8]Xin Lin, et al. Targeting estrogen receptor α for degradation with PROTACs: A promising approach to overcome endocrine resistance. Eur J Med Chem. 2020 Nov 15;206:112689.