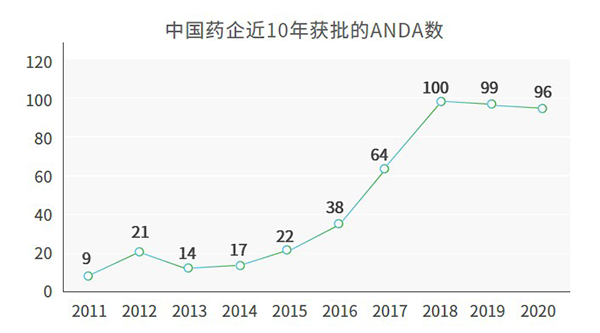
- 國產創新藥取得世界關注近幾年,中國醫藥行業迅猛發展,在國家政策的鼓勵和支持下,國內新藥及仿制藥的研發如雨后春筍般茁壯生長。在這樣的發展勢頭下,我們的醫藥研發不僅為我國的醫藥市場帶來了翻天覆地的變化,也受到了全球醫藥市場的廣泛關注。僅在2020年,獲得FDA批準的藥品就達到96個ANDA,共計81種活性成分,來自26家中國藥企及其子公司。其中12款中國創新藥獲得FDA突破性療法認定或快速通道資格。
 SEND格式與FDA申報
SEND格式與FDA申報- SEND,Standard for Exchange of Nonclinical Data,是對非臨床試驗數據的標準轉化。該標準由臨床數據交換標準協會(Clinical Data Inter-change Standards Consortium, CDISC)的SEND團隊定義并維護的,就如何收集數據、收集什么類型的數據以及如何將數據提交給負責審批新藥的機構提出了規范。
 這一標準旨在幫助藥物審評機構(Center for Drug Evaluations and Research, CDER)的藥理和毒理專家更高效的對新藥項目進行審評,改善美國FDA相關部門與世界醫藥行業的信息溝通。2017年12月18日起,美國FDA要求,申請IND的相關毒理試驗必須采用SEND格式。SEND支持毒理試驗中的單次和多次給藥一般毒性試驗、安全藥理實驗、致癌性試驗、生殖Ⅱ段試驗等試驗數據的格式轉化。
這一標準旨在幫助藥物審評機構(Center for Drug Evaluations and Research, CDER)的藥理和毒理專家更高效的對新藥項目進行審評,改善美國FDA相關部門與世界醫藥行業的信息溝通。2017年12月18日起,美國FDA要求,申請IND的相關毒理試驗必須采用SEND格式。SEND支持毒理試驗中的單次和多次給藥一般毒性試驗、安全藥理實驗、致癌性試驗、生殖Ⅱ段試驗等試驗數據的格式轉化。
 SEND格式是什么樣子?
SEND格式是什么樣子?- SEND格式數據是一份龐大的數據系統,一個小鼠六個月重復給藥試驗的實驗數據就包含了多達36000條原始數據。SEND數據集中主要有.xpt, .xml,.pdf三種文件類型。
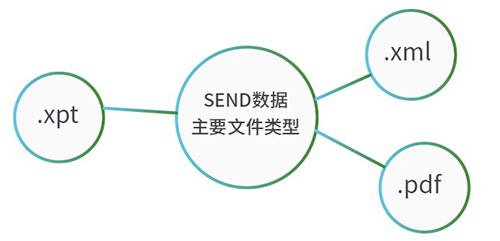 .xpt文件構成了數據中的domain(域),代表了試驗數據的不同種類的合成;.xml文件是編程語言文件,是define文件,描述數據的外部內容,被稱為數據的數據(Metadata);.pdf文件是nsdrg文件,對整個數據集進行說明,包括試驗設計、非受控術語說明、數據集描述、偏差描述。如果把SEND數據集中的domain比作一棵樹,.xml文件就是大樹的軀干,.pdf文件則是樹上的枝葉。
.xpt文件構成了數據中的domain(域),代表了試驗數據的不同種類的合成;.xml文件是編程語言文件,是define文件,描述數據的外部內容,被稱為數據的數據(Metadata);.pdf文件是nsdrg文件,對整個數據集進行說明,包括試驗設計、非受控術語說明、數據集描述、偏差描述。如果把SEND數據集中的domain比作一棵樹,.xml文件就是大樹的軀干,.pdf文件則是樹上的枝葉。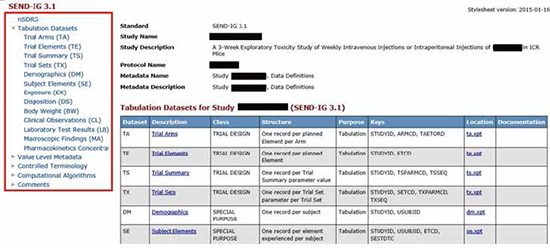 SEND數據集結構
SEND數據集結構
 SEND轉化的標準流程
SEND轉化的標準流程 良好的SEND數據轉換至少需要以下一個方面:軟件系統支持雖然SEND數據轉換可以通過編寫計算機代碼完成,考慮到效率,使用一套轉換軟件系統很有必要;特定素養的人員熟悉各類研究的數據,了解數據間的關系;了解電子數據提交方面的法規文件;規范化的數據采集數據的規范與否直接影響后期的數據轉換工作量。
良好的SEND數據轉換至少需要以下一個方面:軟件系統支持雖然SEND數據轉換可以通過編寫計算機代碼完成,考慮到效率,使用一套轉換軟件系統很有必要;特定素養的人員熟悉各類研究的數據,了解數據間的關系;了解電子數據提交方面的法規文件;規范化的數據采集數據的規范與否直接影響后期的數據轉換工作量。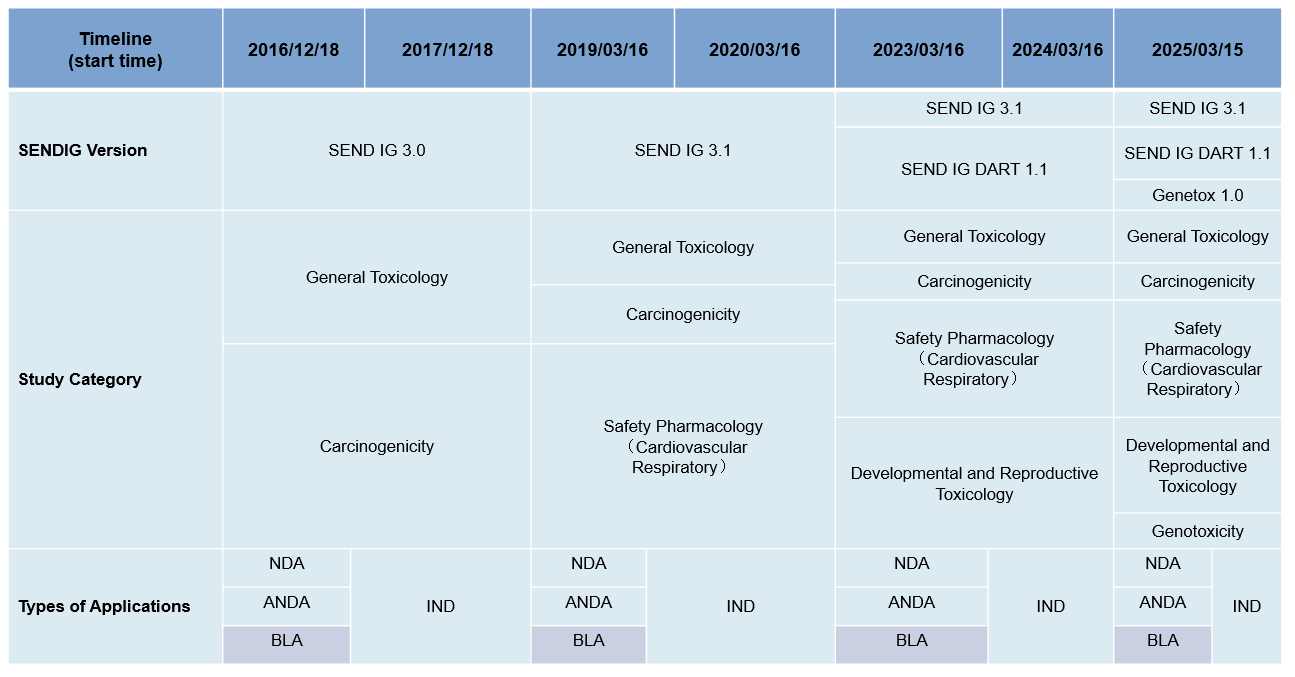 SEND轉換時間節點
SEND轉換時間節點
 知易行難--SEND數據轉換對企業提出的挑戰
知易行難--SEND數據轉換對企業提出的挑戰- 對于醫藥行業來說,SEND格式規范也只是普及了五年的時間,對于中國的醫藥行業來說,依然是新鮮并且相對陌生的,為了能夠吻合SEND數據規范的需求,企業仍需作出很大努力,完成不小的調整和改變。同時SEND標準也在不斷演化改進,并沒有完全定型。因此并沒有一套完美的軟件系統或者操作流程對目前的SEND規范完全適配,供企業選擇使用。對于采用外包模式的企業來說,對不同來源的數據進行SEND轉換也是充滿挑戰性的一個難題。由于不同的服務提供商對于SEND理解和應用的能力相去甚遠,因此選擇一家對于SEND格式轉換有著深刻理解的服務提供商在FDA的IND申報過程中就顯得至關重要。
 美迪西SEND團隊幫您順利實現數據轉換
美迪西SEND團隊幫您順利實現數據轉換- 作為具有全球視野的臨床前研發平臺,美迪西緊跟FDA相關法規的指導要求,針對性的更新并完善全套的臨床前研究、注冊及申報策略,幫助國內外的新藥項目獲得FDA的臨床許可,推動全球新藥研發進程。美迪西的臨床前藥理及毒理研究團隊配備有專業的SEND格式轉換團隊,建立了在軟件、技術、規范、素質等各方面全面成熟的SEND數據轉換平臺,實現精準地數據轉換,為電子數據的提交提供良好環境。在2024年,我們幫助客戶完成了164項SEND數據轉換項目。
 案例
案例獲取更多服務案例,請聯系我們:
 視頻推薦:
視頻推薦: