CDE藥品審評周報(2015.12.20-2015.12.26)
本周63個藥品(按受理號計,下同)進入在審評階段,53個藥品進入審批階段,而有298個藥品審批完畢,260個藥品制證完畢,請先看重點藥物:
重點藥物
1、PLB1003膠囊:本品的原料及2個規(guī)格的膠囊劑均由北京浦潤奧生物科技有限責任公司申報,為1.1類化藥,適應癥為抗腫瘤,目前靶點還未知。2015年6月北京浦潤奧獲得1.1類新藥伯瑞替尼腸溶膠囊的臨床批件,目前未在審評中心臨床試驗登記中心查到關于伯瑞替尼的臨床信息。PLB1003膠囊是該公司申報的第二個1.1類新藥,目前已進入在審評狀態(tài)。
2、注射用頭孢妥侖磷酸鈉:本品的原料及注射劑均由四川科倫(股票代碼SZ002422)藥物研究院有限公司申報,為1.1類化藥。頭孢妥侖4代頭孢類藥物,目前國內已進口上市頭孢妥侖匹酯片,為頭孢妥侖的羧酸酯,而科倫申報的為頭孢妥侖的磷酸鈉鹽,給藥途徑也由口服變?yōu)樽⑸洹1酒?014年4月承辦,為特殊審批品種,經過1次發(fā)補,目前獲批臨床。不過受限抗令的影響,不知市場會怎樣。
3、雙醋瑞因片:本品由安士制藥(中山)有限公司5類申報,目前待生產現(xiàn)場核查。雙醋瑞因為骨關節(jié)炎IL-1的重要抑制劑,用于治療退行性關節(jié)疾病(骨關節(jié)炎及相關疾病),目前國內僅有1家企業(yè)進口上市雙醋瑞因膠囊,且雙醋瑞因片也僅有安士制藥1家申報,此外安士制藥還進口申報了雙醋瑞因的控釋片,這個很看好這個品種嗎?
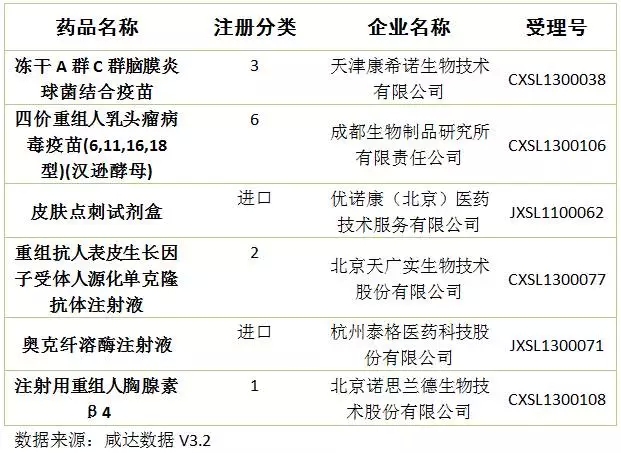
4、注射用重組人胸腺素β4:本品由北京諾思蘭德生物技術股份有限公司(股票代碼SB430047)申報,為1類治療用生物制品。本品2014年4月進入審評中心,屬于重大專項品種,經歷1次發(fā)補,歷時20個月,目前審評完畢,獲批臨床。重組人胸腺素β4可應用于急性心肌梗死、皮膚損傷、角膜損傷和干眼癥,市場前景廣闊啊。
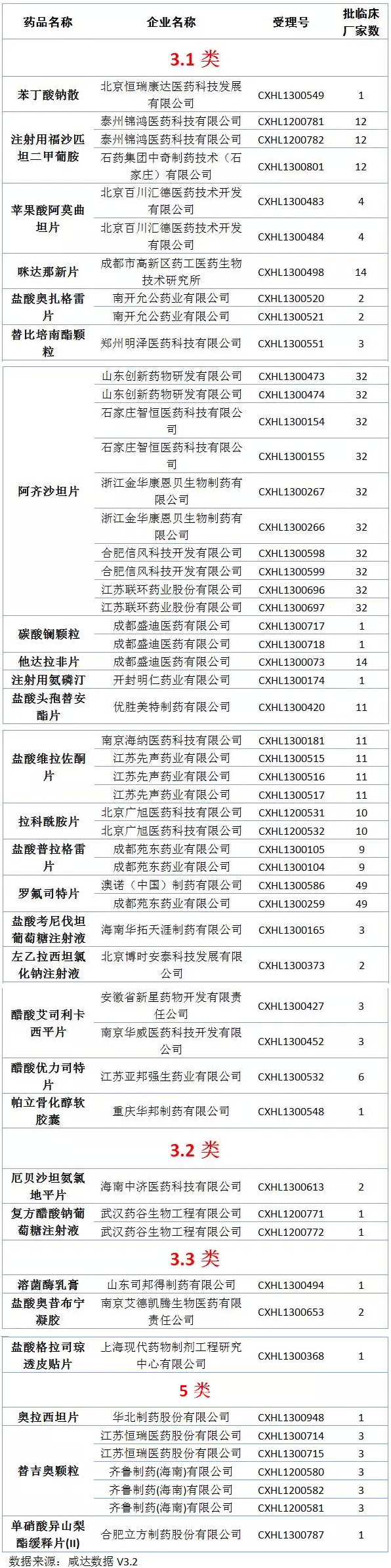
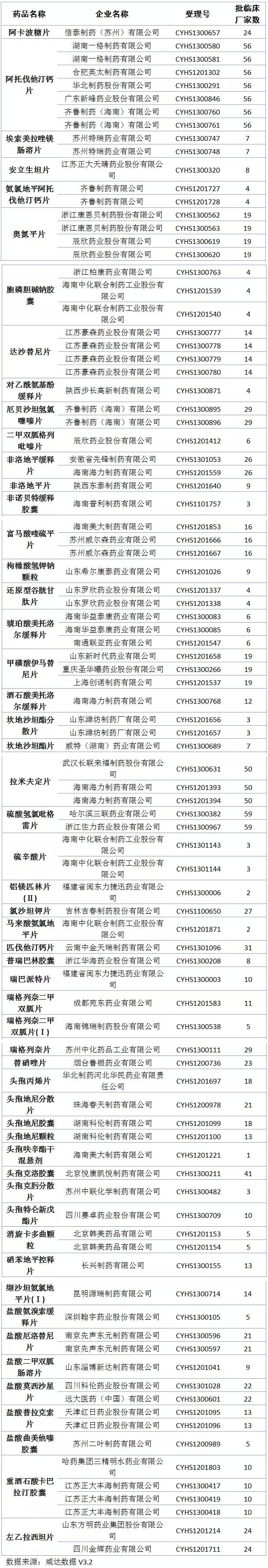
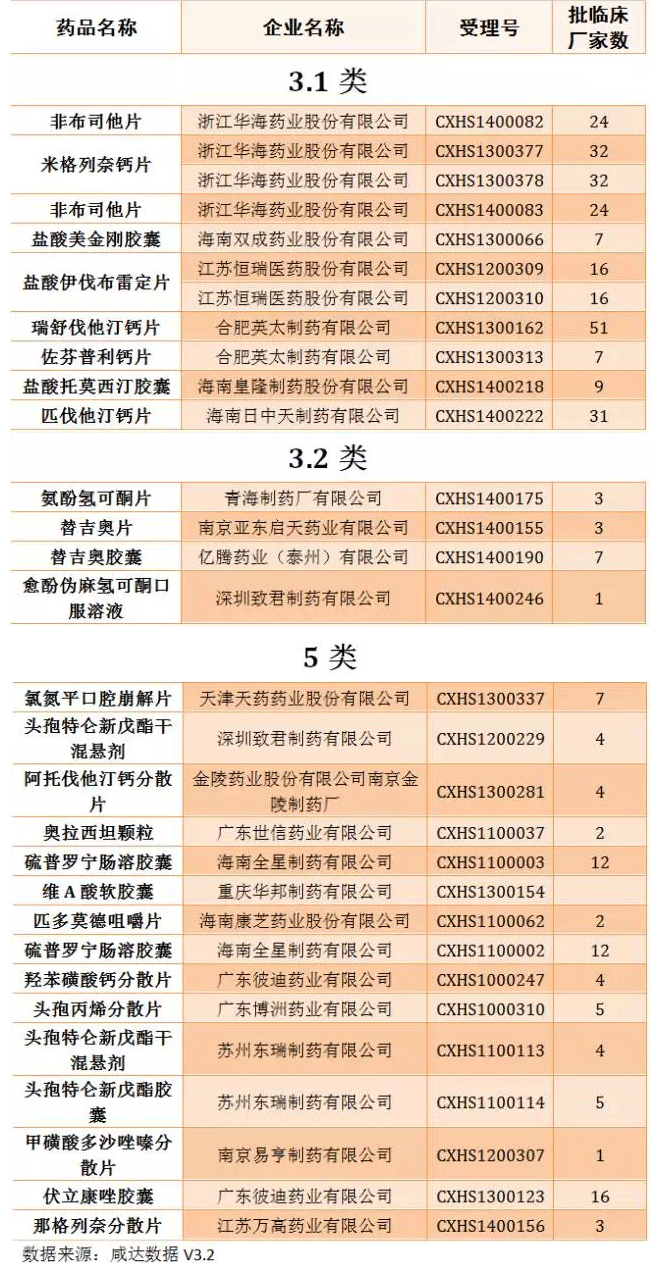
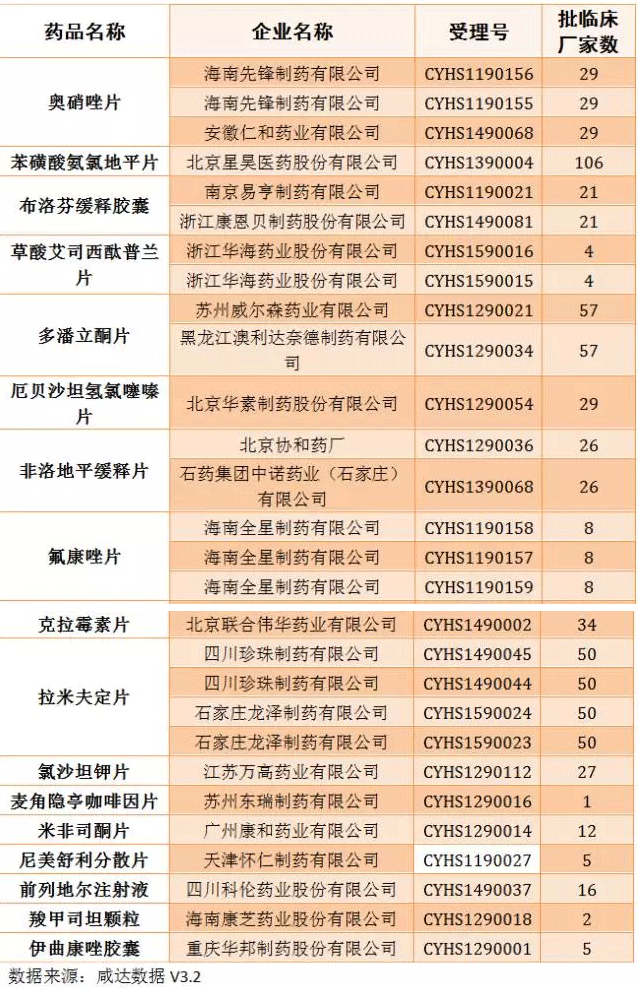
距《Oh My God,11月份又來1300多個臨床批件》發(fā)布還不到一個月,臨床批件數(shù)量又上漲了1000多,達到4357件;咸達在12月15日的文章《當撤回變成一種周更》中統(tǒng)計的撤回數(shù)量已經達到727個,這兩周撤回數(shù)量又增加137個,也許CFDA又要發(fā)公告了。本周審批完畢的藥物中,獲批臨床以及撤回的藥品見下圖:
獲批臨床化藥新藥
仿制藥
生物制品
撤回申請化藥新藥
仿制藥

分享到:













 相關新聞
相關新聞