100個優先審評品種被欽點,市場如何定調?
10月10日,國家食品藥品監督管理總局藥品審評中心對已納入優先審評程序藥品品種進行了公示,共涉及100個受理號。
根據國家食品藥品監督管理總局2月26日發布的《關于解決藥品注冊申請積壓實行優先審評審批的意見》(食藥監藥化管[2016]19號),優先審評程序是為了加強藥品注冊管理,加快具有臨床價值的新藥和臨床急需仿制藥的研發上市,解決藥品注冊申請積壓的矛盾。
審評時間預期進一步縮短
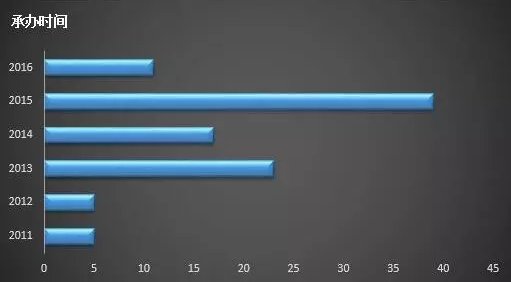
從此次公布的已納入優先審評程序藥品承辦時間來看,等待了4、5年的品種各占了5%,而等待時間在兩年內的藥品總數在67%,未來審評時間肯定還要有所縮短。
CDE公布已納入優先審評程序的品種數量分析
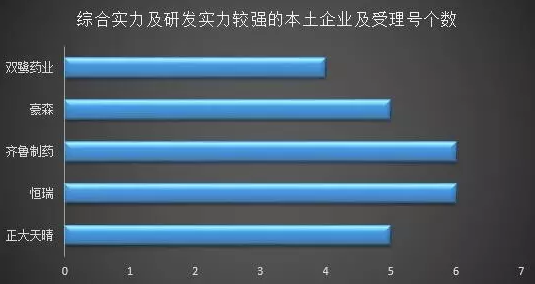
研發實力哪家強?
據統計,在已優先審評受理品種清單中,有66個受理號來自本土藥企。其中,恒瑞有6個,分別是鹽酸右美托咪定鼻噴劑、釓布醇注射液、磺達肝癸鈉注射液、帕立骨化醇注射液、注射用醋酸卡泊芬凈和醋酸卡泊芬凈;齊魯制藥6個,分別是吉非替尼、吉非替尼片、他克莫司滴眼液、氯替潑諾妥布霉素滴眼液、布林佐胺滴眼液和布林佐胺。另外,正大天晴、豪森、雙鷺藥業等均屬于研發實力較強的企業,各有5、5、4個受理品種。
從跨國企業優先審評的品種數量看,截至目前,勃林格殷格翰、諾華、羅氏、艾伯維等14家跨國藥企的34個受理號將享受“快車道”待遇。
新藥研發熱度不減,首仿表現也不俗
從申請類型來看,此次公布品種中,國內注冊共62個受理號,其中,新藥33個,占53.2%,仿制藥29個,占比46.8%。而早前CFDA也曾公布22個擬優先審評的首仿藥物名單,這給了國內仿制藥企業更大的空間和期待。進口注冊共38個受理號,主要為新藥,仿制藥品種僅占5.3%。

化藥研發仍是重頭戲
從品種分析,100個受理號中有95項是化藥申請,5項生物制品申請。化學藥研發仍唱“重頭戲”。生物制品如何迎頭趕上?中藥的出路在哪?小編也將持續關注。
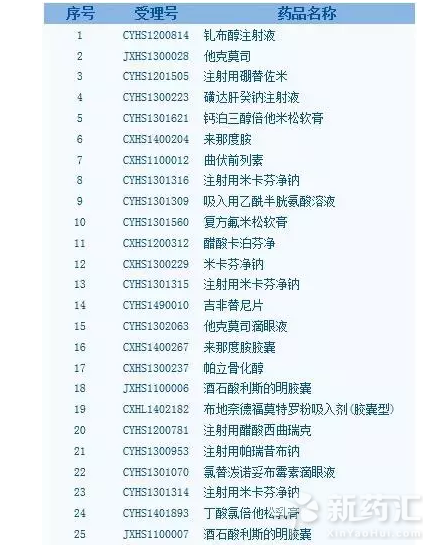
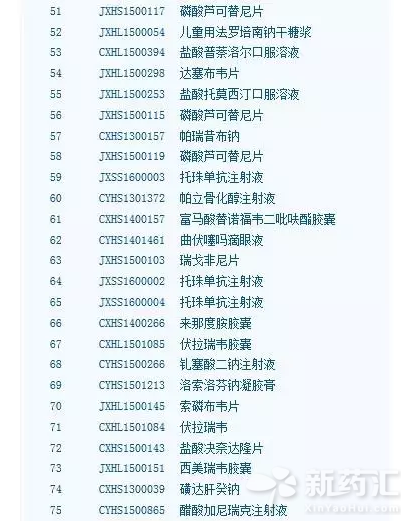
附:
已納入優先審評程序藥品品種


分享到:














 相關新聞
相關新聞