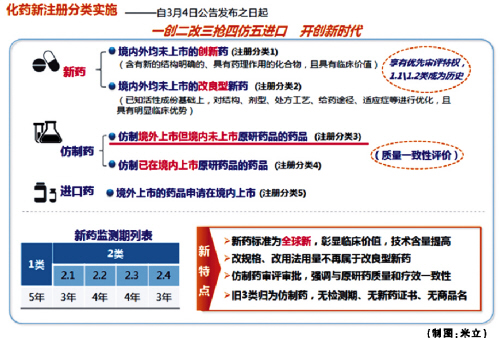
在CFDA出臺(tái)的《化學(xué)藥品注冊(cè)分類改革工作方案》中,新的藥品注冊(cè)管理辦法給新藥做了重新定義。新藥的概念從“中國(guó)新”上升到“全球新”,而3類藥自此被納入仿制藥范疇。值得注意的是,大量申請(qǐng)老3類藥的企業(yè)將面臨巨大挑戰(zhàn),已進(jìn)入臨床階段的老3類藥物和處于注冊(cè)申請(qǐng)受理階段的老3類藥物何去何從?企業(yè)該如何抉擇?
業(yè)內(nèi)人士表示,期待盡快出臺(tái)關(guān)于新3類藥的臨床試驗(yàn)要求,以及新老3類藥物在政策執(zhí)行上如何過(guò)渡等方面的詳細(xì)指導(dǎo)原則。
回歸仿制藥本位
新3類藥物申報(bào)降溫
盡管老3類藥本質(zhì)上屬于仿制藥,但在“新藥”頭銜的庇護(hù)下享有3-4年新藥監(jiān)測(cè)期,即未到期前CDE不再受理相關(guān)進(jìn)口和國(guó)產(chǎn)的注冊(cè)申請(qǐng),這也使得很多企業(yè)在合成工藝、處方工藝等研究不充分的條件下盲目搶奪首仿,很長(zhǎng)一段時(shí)間內(nèi)老3類藥申報(bào)競(jìng)爭(zhēng)非常激烈。
在新的注冊(cè)分類改革下,以首仿藥、搶仿藥為策略的國(guó)內(nèi)企業(yè)將不得不考慮新的出路,同時(shí)新3類藥物申報(bào)熱將大幅降溫。不過(guò),也有分析認(rèn)為搶仿以市場(chǎng)為導(dǎo)向的臨床優(yōu)勢(shì)品種依舊會(huì)迎來(lái)激烈競(jìng)爭(zhēng)。
某藥業(yè)副總經(jīng)理告訴記者,老3類藥物未來(lái)不僅面臨原研藥進(jìn)口的壓力,還要面臨有所提升的仿制藥申報(bào)門檻。“企業(yè)需要對(duì)自身實(shí)力進(jìn)行評(píng)估,比如生產(chǎn)工藝按照現(xiàn)在頒布的分類要求和指導(dǎo)原則對(duì)比原研藥能否達(dá)到等效,如果達(dá)不到標(biāo)準(zhǔn),可能就要考慮重新做甚至是放棄。”
“化學(xué)藥品新注冊(cè)分類申報(bào)資料對(duì)生產(chǎn)工藝、過(guò)程控制、物料控制、關(guān)鍵步驟和中間體的控制都有明確的要求,企業(yè)如果要開發(fā)新3類藥物,除了在技術(shù)上要有強(qiáng)大的支撐外,還需要投入更多的人力、物力和財(cái)力,如參比制劑的購(gòu)買,質(zhì)量標(biāo)準(zhǔn)的購(gòu)買以及短期內(nèi)較多的人員溝通。”某生物醫(yī)藥產(chǎn)業(yè)技術(shù)研究院有限公司總經(jīng)理認(rèn)為,新政策總體要求更嚴(yán)格,很多企業(yè)不會(huì)僅僅看中產(chǎn)品本身市場(chǎng)而進(jìn)行仿制,而是更多地考慮企業(yè)本身的戰(zhàn)略規(guī)劃、投資、研發(fā)實(shí)力等等。
有專家向記者坦言,“以往很多研發(fā)公司出售的都是3類藥物臨床批件,前年還能查到有價(jià)值幾百萬(wàn)元的臨床批件轉(zhuǎn)讓,隨著一致性評(píng)價(jià)等政策門檻的提高,藥品注冊(cè)費(fèi)用上漲,現(xiàn)在這類臨床批件的轉(zhuǎn)讓價(jià)格已經(jīng)大幅度縮水了。”
出現(xiàn)這種現(xiàn)象的根本原因在于,新3類藥定義中強(qiáng)調(diào)了“應(yīng)與原研藥品的質(zhì)量和療效一致”的概念。企業(yè)無(wú)論是轉(zhuǎn)讓還是再開發(fā),都無(wú)法逃避與原研藥進(jìn)行一致性評(píng)價(jià)這道門檻。
老3類藥何去何從?
隨著《仿制藥質(zhì)量和療效一致性評(píng)價(jià)工作程序(征求意見(jiàn)稿)》和《化學(xué)藥品仿制藥口服固體制劑一致性評(píng)價(jià)申報(bào)資料要求(征求意見(jiàn)稿)》等文件的下發(fā),在一致性評(píng)價(jià)大勢(shì)所趨的背景下,未來(lái)三年補(bǔ)充申請(qǐng)的數(shù)量會(huì)大幅上升,而數(shù)量上升又會(huì)造成一定程度上的積壓,同時(shí)投入的成本和未來(lái)市場(chǎng)同樣會(huì)令企業(yè)權(quán)衡,企業(yè)會(huì)做出何種決擇呢?
記者在采訪中了解到,對(duì)于已經(jīng)注冊(cè)獲得臨床批件的老3類藥物,企業(yè)的當(dāng)務(wù)之急是評(píng)估產(chǎn)品的臨床價(jià)值和市場(chǎng)價(jià)值,進(jìn)而判斷是否有繼續(xù)下去的必要。有專家根據(jù)已公布的政策分析認(rèn)為,“應(yīng)該是BE和100對(duì)隨機(jī)臨床對(duì)照試驗(yàn)都要做的,按照現(xiàn)在臨床數(shù)據(jù)的核查情況,企業(yè)至少要投入不菲,即使臨床順利完成,按照230號(hào)公告,藥品上市后3年內(nèi)仍然要完成一致性評(píng)價(jià),否則將注銷藥品批準(zhǔn)文號(hào)。”
專家還表示,盡管理論上企業(yè)可以撤回已申報(bào)的老3類藥物注冊(cè)申請(qǐng),按照新分類注冊(cè)要求重新申報(bào),但由于撤回申請(qǐng)代價(jià)較大,大多數(shù)企業(yè)可能會(huì)保持觀望態(tài)度等待政策進(jìn)一步明朗化。
“以往國(guó)內(nèi)仿制藥市場(chǎng)要拼速度、拼占坑的先來(lái)后到,現(xiàn)在逐漸有和美國(guó)仿制藥市場(chǎng)接軌的趨勢(shì),即在仿制藥質(zhì)量、療效與原研產(chǎn)品一致的基礎(chǔ)上比拼價(jià)格,誰(shuí)的價(jià)格低,市場(chǎng)占有率就高。”某藥業(yè)經(jīng)理認(rèn)為,國(guó)內(nèi)企業(yè)能否通過(guò)一致性評(píng)價(jià)將決定其在招標(biāo)以及價(jià)格上的優(yōu)勢(shì)。”
不過(guò),一位從事藥品政策研究的教授告訴記者,通過(guò)一致性評(píng)價(jià)的仿制藥優(yōu)惠政策并沒(méi)有作為硬性規(guī)定,具體落實(shí)有待觀察。未來(lái)仿制藥市場(chǎng)的優(yōu)勝劣汰仍需要一段時(shí)間檢驗(yàn),擁有新劑型、新工藝等形成一定技術(shù)壁壘的仿制藥企業(yè)可能會(huì)脫穎而出。
對(duì)此,某生物醫(yī)藥產(chǎn)業(yè)技術(shù)研究院有限公司總經(jīng)理同樣認(rèn)為仿制藥企未來(lái)將面臨來(lái)自BE試驗(yàn)與審評(píng)的雙重壓力。一方面企業(yè)有意愿做BE試驗(yàn),但受臨床實(shí)驗(yàn)數(shù)據(jù)自查影響,臨床機(jī)構(gòu)的積極性不高,不愿意承擔(dān),BE試驗(yàn)無(wú)地可做;另一方面,仿制藥僅排隊(duì)待審評(píng)就長(zhǎng)達(dá)2-3年,補(bǔ)充申請(qǐng)可能會(huì)進(jìn)一步加劇注冊(cè)積壓的情況,再次導(dǎo)致審評(píng)時(shí)效不可控。他指出,通過(guò)集中審評(píng)的手段解決注冊(cè)積壓?jiǎn)栴}治標(biāo)不治本,“應(yīng)當(dāng)從政策上引導(dǎo)企業(yè)理性申報(bào),以品種的臨床價(jià)值為衡量指標(biāo),達(dá)到企業(yè)理性申報(bào),政府規(guī)范有效審評(píng),即合理加快審評(píng)進(jìn)度,完善審評(píng)制度等,形成審評(píng)進(jìn)出品種平衡,申報(bào)審批良性發(fā)展,營(yíng)造良好的醫(yī)藥研發(fā)環(huán)境,各方共同努力為醫(yī)藥行業(yè)的發(fā)展做出貢獻(xiàn)。”









 相關(guān)新聞
相關(guān)新聞