2006-2015年10年間,美國FDA通過加速審批共批準包括13個化學藥和4個生物制劑在內(nèi)的17個血液科抗腫瘤藥,所涉及的適應癥有白血病、淋巴瘤和多發(fā)性骨髓瘤。在獲準的13個化學藥物中,有11個新分子實體,2個新制劑(口服氟達拉濱磷酸酯片和硫酸長春新堿脂質(zhì)體)。
總體概況
十年十個藥物
2006-2015年10年間,美國FDA通過加速審批共批準10個可用于治療白血病的藥物,即:達沙替尼、尼洛替尼、奧法木單抗、高三尖杉酯堿、帕納替尼、依魯替尼、艾德拉尼、Blinatumomab(Blincyto)、口服氟達拉濱磷酸酯片和硫酸長春新堿脂質(zhì)體。
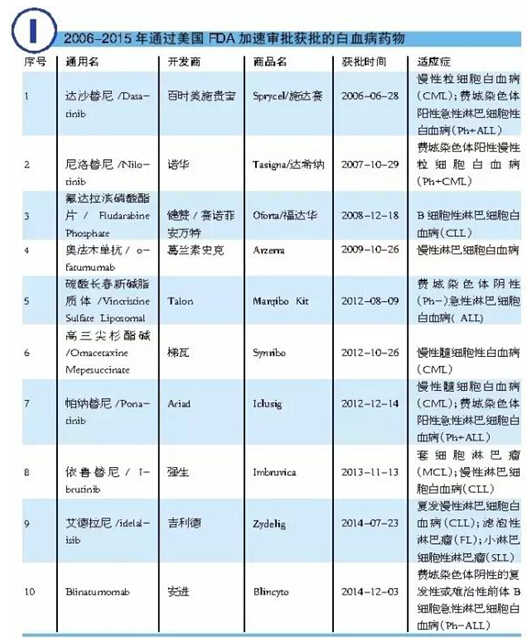
在這10個藥物中,口服氟達拉濱磷酸酯片現(xiàn)已在美國停止上市。我國CFDA于2006年4月批準了德國拜耳的口服氟達拉濱磷酸酯片(商品名:福達華)進口中國,該產(chǎn)品至今仍然活躍于我國抗腫瘤藥物市場上。此外,于2012年8月9日獲得美國FDA批準的硫酸長春新堿脂質(zhì)體由Talon開發(fā),臨床上用于治療費城染色體陰性急性淋巴細胞白血病,針對的患者主要是白血病復發(fā)和曾進行過兩次失敗治療的群體。該藥主要成分為常用的抗腫瘤藥長春新堿,每周注射1次。
值得一提的是,于2012年12月獲批的高三尖杉酯堿由梯瓦開發(fā),臨床上用于酪氨酸激酶抑制劑治療后依然進展的成人慢性髓細胞性白血病(CML)患者的治療。高三尖杉酯堿是美國FDA批準的首個用于治療CML的蛋白質(zhì)合成抑制劑。高三尖杉酯堿是從我國特有的三尖杉屬植物海南粗榧中分離得到的小分子天然產(chǎn)物。我國是世界上首先將高三尖杉酯堿用于CML治療的國家,后期逐漸用于急性髓細胞性白血病(AML)的聯(lián)合治療。此外,還用于治療骨髓增生異常綜合癥(MDS)。我國目前共有3張高三尖杉酯堿原料藥生產(chǎn)批文、12張注射劑生產(chǎn)批文。
品種表現(xiàn)
達沙替尼:市場潛力巨大
全球:2015年銷售額16.20億美元
國內(nèi):正大天晴首仿,緊隨其后者眾
達沙替尼是一種Bcr-Abl和Src激酶雙重抑制劑,其作用強度是伊馬替尼的325倍,是尼洛替尼的16倍。臨床試驗證實,達沙替尼可有效克服伊馬替尼的耐藥,對伊馬替尼耐藥或不耐受的患者具有顯著和持久的療效。同時,達沙替尼耐受性良好,不良反應可逆且容易處理,可有效克服使用伊馬替尼治療時患者因不能耐受而中斷治療或依從性不佳的問題。總之,達沙替尼的問世對于那些對伊馬替尼耐藥以及對伊馬替尼不能耐受的患者提供了一種新的治療方案。
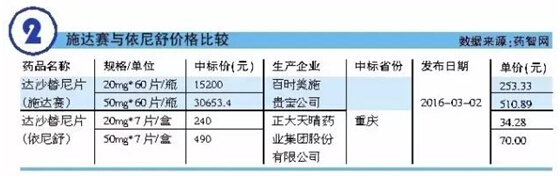
我國CFDA已于2011年9月7日批準百時美施貴寶公司的達沙替尼片(商品名:施達賽)進口中國。此外,由連云港潤眾制藥有限公司開發(fā)的原料,以及由正大天晴藥業(yè)集團股份有限公司開發(fā)的片劑(規(guī)格:20mg、50mg和70mg)已于2013年9月17日獲得我國CFDA頒發(fā)的生產(chǎn)批文。正大天晴的達沙替尼片(商品名:依尼舒)也因此成為國內(nèi)首仿品種。此外,北京雙鷺藥業(yè)股份有限公司已按原3.1類完成有關(guān)本品的臨床試驗,并已申報生產(chǎn),現(xiàn)處于待審評階段。而南京圣和藥業(yè)有限公司的產(chǎn)品現(xiàn)正處于臨床試驗階段(試驗登記號:CTR20150207)。
來自EvaluatePharma的數(shù)據(jù)顯示,早在2012年達沙替尼的全球年銷售額就已突破10億美元,成為名副其實的重磅炸彈類藥物。分析師曾預測達沙替尼將于2018年全球銷售額達20.85億美元。百時美施貴寶公司企業(yè)年報數(shù)據(jù)顯示,2015年達沙替尼全球年銷售額已達16.20億美元,同比增長7.26%。可見,達沙替尼市場潛力不可估量。據(jù)悉,作為國內(nèi)首仿藥的依尼舒,其價格僅為原研藥施達賽的1/7,國內(nèi)眾多CML患者將從中獲益。
尼洛替尼:國內(nèi)最暢銷替尼類藥之一
全球:2015年銷售額16.32億美元
國內(nèi):原研藥表現(xiàn)不俗,2015同比增244.7%;國內(nèi)多家企業(yè)申報
尼洛替尼是一種具有高度選擇性的酪氨酸激酶抑制劑,其通過選擇性抑制酪氨酸激酶及其編碼基因常見突變,達到抑制由其突變引起的費城染色體陽性慢性粒細胞白血病(Ph+CML)。尼洛替尼對BCR-ABL比伊馬替尼具有更高的親和力和特異性。尼洛替尼在全球大多數(shù)國家獲準用于治療新診斷的慢性期、Ph+的成人CML患者,以及慢性期和加速期、Ph+且對包括伊馬替尼在內(nèi)的既往治療耐藥或不耐受的成人CML患者。2010年,美國FDA正式批準尼洛替尼用于CML一線治療。
目前,本品尚未國產(chǎn)化,但我國CFDA已于2009年7月14日批準諾華公司的達沙替尼膠囊(商品名:希達納)進口中國。此外,據(jù)悉國內(nèi)已有多家企業(yè)向我國CFDA提出有關(guān)本品的注冊申請。
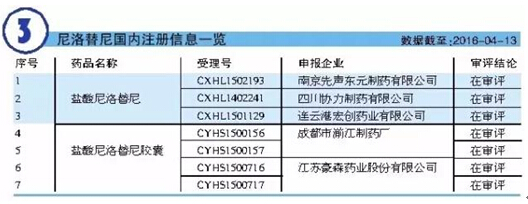
分析師曾預測尼洛替尼2018年全球銷售額將達到24.38億美元。諾華公司企業(yè)年報數(shù)據(jù)顯示,2015年尼洛替尼的全球銷售額為16.32億美元,同比增長6.73%。此外,來自IMS的數(shù)據(jù)顯示,2015年我國22城市樣本醫(yī)院尼洛替尼年銷售金額為6380.5萬元,同比增長244.7%。尼洛替尼已成為我國最暢銷的替尼類藥物之一。
依魯替尼:未來該治療領(lǐng)域佼佼者
全球:2015年銷售額14.43億美元
國內(nèi):進口注冊申請待審評;國內(nèi)多家企業(yè)提出仿制申請
依魯替尼是美國FDA批準的首個口服布魯頓酪氨酸激酶(BTK)抑制劑。依魯替尼通過與靶蛋白BTK活性位點半胱氨酸殘基(Cys-481)選擇性地共價結(jié)合,不可逆地抑制BTK,從而有效阻止腫瘤從B細胞遷移到適應于腫瘤生長環(huán)境的淋巴組織。
2013年11月13日,依魯替尼獲美國FDA加速審批用于治療套細胞淋巴瘤(MCL),從而成為繼美國FDA有史以來批準的第3個用于治療該疾病的藥物(另外2個藥物分別是2006年獲批的硼替佐米和2013年獲批的來那度胺)。2014年2月12日,F(xiàn)DA批準依魯替尼用于先前接受過至少一種藥物治療的慢性淋巴細胞白血病(CLL)。2015年1月,依魯替尼獲FDA批準用于治療Waldenstrom巨球蛋白血癥(WM),從而成為首個治療該疾病的藥物。此外,依魯替尼用于治療彌漫性大B細胞淋巴瘤、濾泡行淋巴瘤和胰腺癌尚處于臨床階段。
本品目前尚未進口中國,但原研公司已于2014年1月向我國CFDA提出依魯替尼膠囊的進口注冊申請(受理號:JXHL1300519),目前正處于待審評階段。此外,本品國內(nèi)企業(yè)關(guān)注度較高,國內(nèi)目前已有包括浙江海正、徐州萬邦和杭州中美華東等在內(nèi)的多家企業(yè)已提出注冊申請。
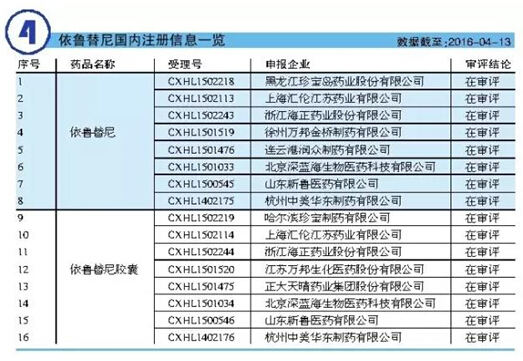
依魯替尼現(xiàn)已在近50個國家或地區(qū)上市,并有望成為未來血液系統(tǒng)抗惡性腫瘤領(lǐng)域的佼佼者。分析師曾預測,依魯替尼的全球年銷售額有望突破50億美元。來自公司年度財務報表數(shù)據(jù)顯示,2015年依魯替尼全球銷售額為14.43億美元,同比增長108.4%,其市場潛力漸已凸顯。以此推斷,依魯替尼實現(xiàn)50億美元的年銷售額并非傳說,其未來市場走勢值得期待。












 相關(guān)新聞
相關(guān)新聞