國內首個“格列凈”藥物即將上市兼評國內注冊分析
目前全球共有6款“列凈”類單方藥物上市,分別為:Canagliflozin(卡格列凈/坎格列凈)、Dapagliflozin(達格列浄)、Empagliflozin(恩格列凈/艾格列凈)、Ipragliflozin(伊格列凈/依格列凈)、Luseogliflozin(魯格列凈)以及tofogliflozin(托格列凈)。其中FDA批準的只有前3種,后三種由日本厚生勞動省批準上市。卡格列凈是FDA批準的第一款“列凈”類藥物(2013年3月獲批),達格列浄是EMA批準的第一款“列凈”類藥物(2012年11月獲批)。
目前國內有2款列凈類藥物已申報進口上市,分別為阿斯利阿康的達格列浄,以及勃林格殷格翰的恩格列凈。
達格列浄:受理號為JXHS1500112和JXHS1500113,2015年12月承辦,目前已于2016年6月16日滅燈,應該是已經審評完畢,審評時的備注為“食藥監藥化管便函[2014]729號過渡期品種”。達格列浄可能是國內上市的第一款“列凈類”降糖藥,市場可想而知。
恩格列凈:受理號為JXHS1600050和JXHS1600051,2016年5月承辦,目前還未進入序列,根據達格列浄的速度,可能半年后會審評完畢。
目前FDA批準的第一款卡格列凈還未在國內申報上市,近期又出現卡格列凈可能導致下肢截肢(主要是腳趾)風險增加而受到FDA和EMA關注的消息,不知其安全性是否會延伸至本類藥物的安全性。
下面說說國內1.1類列凈以及3.1類列凈的申報情況吧:
首先,1.1類和3.1類沒有上市申請,均為臨床申請,從去年集中審評開始已陸陸續續有很多企業獲得臨床批件。
小編使用“列凈”為藥品的關鍵詞在咸達數據V3.2數據庫的注冊庫中進行模糊檢索(截止時間2016年6月19日),共得到227個受理號,其中進口申請32個,新藥申請192個(14個1.1類,170個3.1類,8個3.2類),補充申請3個。進口在此不多做介紹,主要介紹國內的申報:
首先呈現1.1類:
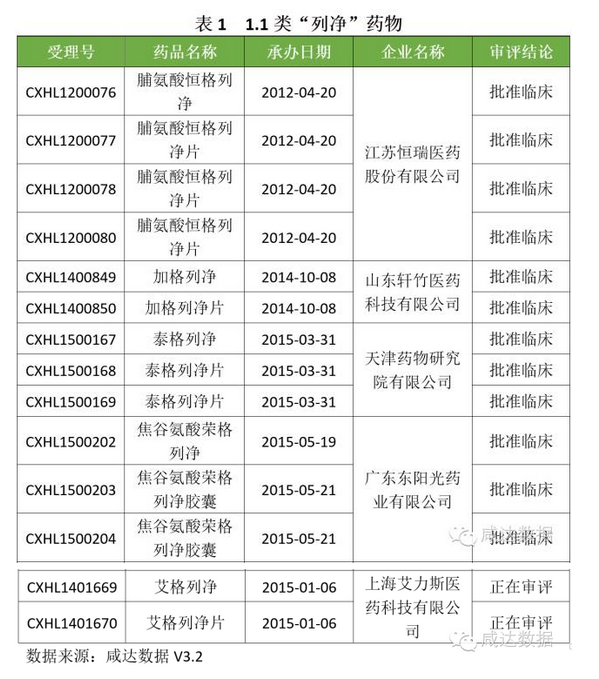
對于170個3.1類受理號,最多的是卡格列凈及其片,共63個;其次是恩格列凈及其片劑,共47個;再次是達格列浄及其片劑,共38個;第四是依格列凈及其片劑,共17個;最后是托格列凈,共2個受理號。
卡格列凈:對于卡格列凈目前已有18家公司審評完畢,其中江蘇豪森、正大天晴、四川科倫、揚子江藥業、天津市漢康、山東羅欣、齊魯制藥、湖北華世通、江蘇先聲、杭州華東醫藥、重慶醫藥工業研究院、南京卡文迪許等前后獲得臨床批件。豪森于今年年初第一個獲得臨床批件,目前還未在CDE臨床試驗公示平臺上登記。此外,還有5家在CDE排隊待審評。
恩格列凈:對于恩格列凈目前共有9家公司審評完畢,江蘇豪森、山東羅欣、四川科倫、江蘇奧賽康、正大天晴等分別前后獲批臨床。豪森又是第一家,于今年3月份獲批,但是其余幾家的獲批時間相差不大,以后的臨床之路還長著呢。同樣,也沒有臨床試驗的登記信息。此外,還有7家在CDE排隊待審評。
達格列浄:對于達格列浄,目前共有9家審結完畢,江蘇豪森、安徽聯創、北京陽光諾和、石家莊智恒、湖北華世通、南京恩泰、南京卡文迪許等分別前后獲批臨床。江蘇豪森再一次拔得頭籌,在這里要熱烈祝賀一下。同樣,也沒有國內企業的臨床試驗登記信息。此外,還有4家在CDE排隊待審評。
依格列凈:本品目前只有南京華威1家于今年5月份獲得臨床批件,其他有5家企業排隊待審評。
托格列凈:本品目前只有南京華威1家于今年申報,6月初底由CDE承辦。
以上信息可以了解到,豪森應該是最大的贏家,正大天晴、南京華威、四川科倫、齊魯制藥等其他廠家也不是很遜色。至于誰能第一個仿制上市,那真的要看臨床的真本事了。
對于8個3.2類藥物,主要是卡格列凈+二甲雙胍以及恩格列凈+利格列汀的申報,前者為哈爾濱珍寶和杭州華東醫藥2家申報,后者為山東羅欣1家申報。目前哈爾濱珍寶的已經處于審批階段,而其他的仍然在審評。

分享到:









 相關新聞
相關新聞