新藥審評是美國食品藥品管理局(簡稱FDA)重要職能之一。FDA將加快新藥審評、促進創新發展作為其一項重要使命。近年來,FDA開展了一系列改革活動,大大縮短了新藥審評時間。從1992年平均需要二年半時間審評一個新藥到目前不到十個月審評一個新藥,為重癥患者獲得急需新藥贏得了寶貴時間,也為自己樹立了一個高效政府機構新形象。
一、FDA簡介
FDA是美國歷史最悠久的保護消費者組織之一,共約有全職員工15700人,分布在美國各主要城市以及中國、英國、比利時、意大利、印度、墨西哥、智利、哥斯達黎加、南非和約旦等10個國家。其監督管理的產品包括:食品、人用藥品、人用生物制品、獸用藥品、化妝品、醫療機械、放射性機電產品(包括手機、微波爐等)以及煙草產品,每年監督管理的產品價值超過2萬億美元。2015年度FDA財政預算為47.4億美元。
FDA局長由美國總統提名并經參議院表決批準。FDA總部劃分為五大辦公室,分別是局長辦公室、食品和獸藥辦公室、藥品和煙草產品辦公室、全球監管和政策辦公室,以及運行辦公室。為履行監管職責,FDA在全國各地設立了許多派出機構。派出機構的總人數約為4500,約占FDA總人數的三分之一。以下重點介紹FDA總部負責新藥審評的藥品審評與研究中心。
藥品審評與研究中心歸FDA藥品和煙草產品辦公室管理。藥品審評與研究中心共有4508名員工,劃分為12個辦公室,分別是:中心主任辦公室,對外溝通與交流辦公室,法規依從辦公室,仿制藥辦公室,管理辦公室,醫學政策辦公室,新藥辦公室,藥品質量辦公室,監管政策辦公室,戰略項目辦公室,監測和流行病學辦公室,轉化醫學辦公室。新藥辦公室是藥品審評與研究中心的主要辦公室,細分為6個辦公室,分別對各類不同的新藥進行審評,分別是:抗菌藥辦公室,負責對抗菌新藥的審評;第一藥品審評辦公室,負責對心血管、腎臟、神經以及精神類疾病新藥的審評;第二藥品審評辦公室,負責對麻醉、止痛、成癮類、代謝、內分泌、肺、風濕類疾病新藥的審評;第三藥品審評辦公室,負責皮膚、胃腸、先天性代謝缺陷、骨、生殖、泌尿疾病新藥的審評;第四藥品審評辦公室,負責醫學影像產品的審評;血液和腫痛藥品審評辦公室,負責對血液和腫瘤疾病新藥的審評。

二、新藥審評基本程序
新藥審評包括兩個過程:一個是新藥臨床試驗申請(簡稱IND)審評過程,另一個是新藥上市申請(簡稱NDA)審評過程。
(一)IND審評
新藥申請人完成新藥臨床前研究后,就可以向FDA提出IND。如FDA在收到IND之后的30天內未提出反對意見,申請人就可以自行開展新藥臨床研究。據FDA統計分析,每5 000種進入臨床前研究的化合物,僅有5種左右能進入人體實驗階段,最終僅有1種化合物獲得上市許可。
IND審評是聯系新藥臨床前研究與臨床研究的中間環節。IND審評的目的是確保新藥臨床研究的安全性,以避免給臨床試驗受試者帶來不必要的風險。IND主要包括兩種類型:一種是“商業性IND”,最終目的是為了使新產品獲得上市許可,另一種是“非商業性IND”,目的是為了非商業性學術研究,通常由政府機構或科研院所提出這類申請。FDA收到的IND申請大多數屬于“非商業性IND”。
IND審評主要側重于安全性審評。如果FDA對審評結果滿意,在收到IND資料后的30天內未做出暫停臨床研究的決定,申請人就可以立即開展臨床研究。值得注意的是,藥品審評與研究中心對IND審評合格的申請并不發出審評合格的通知,故有“沒有消息就是好消息”的說法。如果FDA認為IND資料尚存在某些微小缺陷,但不足以作出暫停臨床研究的決定,申請人可以在對缺陷項目進行整改的同時開展臨床試驗。
(二)NDA審評
NDA審評是藥品上市前的重要環節。NDA審評的最主要目的是為了確保上市藥品的安全有效、質量可控。NDA申報材料主要包括以下15個方面的內容:索引,摘要,化學、生產工藝及質量控制方面數據,樣品、包裝及標簽,非臨床藥理和毒理數據,人體藥代動力學和生物利用度數據,微生物學數據(僅限于抗生素類藥品),臨床數據,安全性數據更新報告(一般在NDA申報120天后上報),統計學數據,病例報告表,病例報告格式,專利信息,專利聲明,其他有關信息。
藥品審評與研究中心將申請NDA的新藥劃分為以下10類:
第1類系指新的分子結構(指從未在美國上市的活性成分);
第2類系指新的活性成分(指已上市產品的新鹽結構或新酯結構等);
第3類系指新的劑型;
第4類系指新的組合產品;
第5類系指新的配方或新的生產廠家;
第7類系指已在市場銷售但未獲得NDA批準的藥品;
第8類系指非處方藥轉換;
第6、9、10類系指新的適應癥(針對適應癥變化的不同情形)。
藥品審評與研究中心將申報的新藥按兩種審評機制進行審評。一種是正常審評機制;另一種是優先審評機制。
NDA審評主要目的是驗證申請人所得出的結論是否正確,藥品是否安全有效、質量可控。藥品審評與研究中心內部審評人員在審評新藥時要展開廣泛的交流討論。例如,醫學審評人員在分析臨床數據時可能與申請人得出不同的結論,這時醫學審評人員就可能與統計學審評人員進行探討,了解從統計學角度如何看待這個問題。同樣,藥理學審評人員可能與統計學人員進行密切交流,探討藥品長期動物實驗造成潛在致癌性的統計學意義。當藥品審評結束時,每個審評員分別寫出一份審評報告,交由部門負責人進行匯總分析,并做出是否批準上市的決定。
NDA審評結束時,藥品審評與研究中心將根據審評結果,分別做出同意上市、暫不同意上市或不同意上市三種決定。收到同意上市決定的產品可立即在美國上市,收到暫不同意上市決定的產品需要就某些細節問題進行修改或補充有關資料,收到不同意上市決定的產品需進行較大范圍的變更或補充資料。一般來說,產品上市許可決定由處長簽發,但第1類產品上市許可決定需要更高一級的辦公室負責人簽發。例如,藥品審評與研究中心的第一藥品審評辦公室下設3個處,分別是心血管、腎臟類產品處,神經類產品處,以及精神類產品處。通常都是這3位處長負責簽發新藥上市許可決定,只有第1類產品上市許可決定由第一藥品審評辦公室主任簽發。
三、FDA加快新藥審評政策
美國、歐洲和日本是人用藥品注冊技術規定國際協調會議(ICH)的創始成員單位,在藥品注冊審評方面采用許多相同或相似的技術指南,但在新藥審評速度方面,美國卻明顯快于歐洲和日本,很多全球創新性新藥率先在美國獲得上市許可。2013年美國FDA共批準27個新藥,其中20個新藥系全球首次上市的新藥,首次上市的比例高達74%。
美國《處方藥用戶付費法案》規定,對屬于優先審評的創新藥,美國FDA應在6個月內完成百分之九十的品種審評。對屬于正常審評的創新藥,美國FDA應在10個月內完成百分之九十的品種審評。2014年美國FDA共批準41個創新性新藥,其中40個新藥在6個月或10個月內完成審評。
FDA主要有四種新藥加快審批途徑,分別是快速通道、突破性療法、加速批準和優先審評。快速通道針對的是治療嚴重疾病且目前臨床用藥空缺的新藥,突破性療法針對的是對現有療法有明顯改善的新藥,加速批準針對的是目前臨床用藥空缺、基于替代終點而批準的新藥,優先審評是指在申請受理后6個月內完成審評的新藥。
這四種途徑的主要異同點如下:
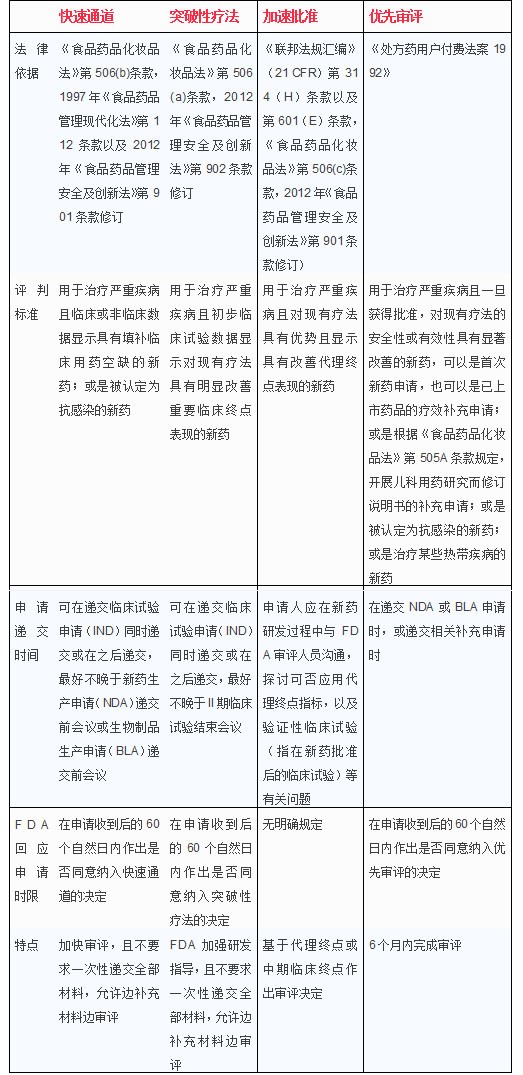
盡管四種快速審評途徑的評判標準各不相同,但實際上四種快速途徑之間存在相似性,一種新藥往往可以獲得不止一種快速審評通道。例如,2014年FDA共批準41個新藥,其中納入快速通道的新藥17個,占41%,納入突破性療法通道的新藥9個,點22%,納入加速批準通道的新藥8個,占22%,納入優先審評通道的25個,占61%。在41個新藥當中,其中27個新藥獲得不止一種快速審評通道,比例高達66%。
四、美國加快新藥審評最新立法進展
盡管美國新藥審評速度遙遙領先于其他國家,但美國并不因此故步自封。2015年7月10日,美國眾議院以344票贊成、77票反對的投票結果輕松通過了《21世紀治療法案》(21st Century Cures Act)。該法案長達362頁,其核心是加快新藥研究、開發和審評。目前該法案正在美國參議院審議之中。
盡管《21世紀治療法案》能否最終通過參議院表決,目前還不得而知,但從該法案在眾議院獲得的廣泛支持來看,參議院通過該法案的可能性較大。法案有關藥品審評的主要內容包括:
(一)準許FDA提高員工工資待遇,以幫助FDA招聘和留住優秀高端人材。以前美國法律規定,FDA的高級雇員人數不得超過500名,工資待遇不得超過行政I級。2015年美國行政I級的年收入為203700美元。美國國務卿等21名高官為行政I級待遇。新法案規定FDA的高級雇員人數將不受限制,只要符合任職條件就可以聘任為高級雇員;同時,準許優秀高端人材的工資待遇超過行政I級,只有不超過美國總統年薪即可。目前美國總統年薪為40萬美元。法案希望通過此舉將流向藥品生產企業或醫療器械生產企業的高端人材吸引到FDA任職。
(二)增加國立衛生研究院和FDA年度預算。醫藥基礎研究是發現新藥的重要源泉。基礎研究取得突破往往能帶動一批新藥產品的開發。據分析,該法案之所以能高票在眾議院獲得通過,很重要一個原因是國會議員們高度贊同法案中關于給美國國立衛生研究院(簡稱NIH)增加年度預算的條款。2015財年NIH的預算為303億美元。如法案獲得通過,2016、2017、2018財年NIH預算將分別增加到318億美元、333美元、348億美元。另外,NIH還將新設立創新基金,鼓勵醫學前沿學科研究和優秀青年科學家創新。未來5年FDA也將新獲得5.5億美元撥款,用于藥品監管科學研究。
(三)鼓勵FDA藥品審評制度改革,將患者意見和建議更多納入藥品審評決定中。美國國會認為,沒有人比患者更能理解疾病所帶來的痛苦,也沒有人比患者更有資格權衡某一藥品的風險和益處。因此藥品審評過程中應該充分考慮患者的意見和建議。
(四)鼓勵FDA進一步研究加快藥品審評的手段,如擴大生物標記物的應用等。
(五)加快抗菌藥的研發,允許僅經過小范圍臨床試驗就批準某些抗菌藥。
(六)準許具有重大創新的醫療器械產品納入FDA加快審評通道。
(七)將罕見病的新適應癥獨占期延長6個月。










 相關新聞
相關新聞