2016年12月歐美日新批準藥物
12月份歐美日新藥批準上市數量(包括新藥、新適應癥和新復方新劑型等)比11月份較多,美國9個、歐洲5個、日本25個。值得關注的是FDA批準了第二個PARP抑制劑和輝瑞收購Anacor制藥的crisaborole,均是提前獲批。歐洲批準了首個Bcl-2抑制劑和奧貝膽酸上市。日本批準史上最好的乙肝新藥Vemlidy。
FDA新批準藥物
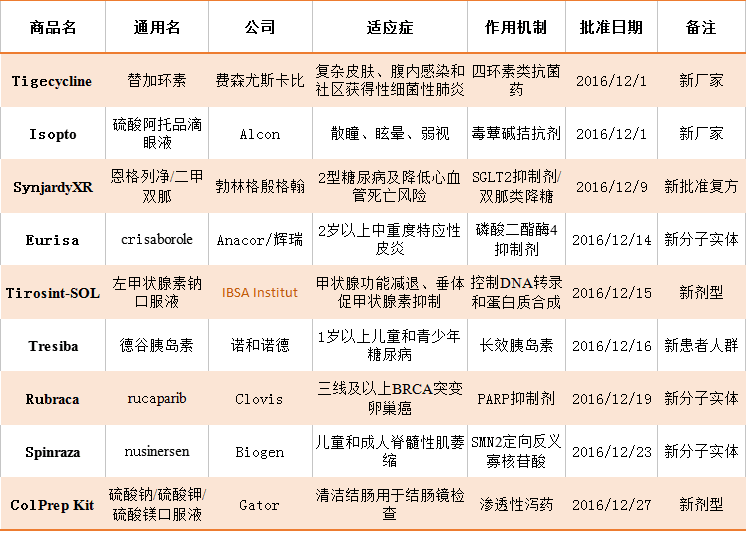

Rucaparib(PARP抑制劑)作為三線以后藥物用于BRCA變異晚期卵巢癌,是FDA批準的該靶點第二個新藥,比原定批準日期提前了2個月,Rucaparib在兩個二期臨床共106位病人中顯示54%的應答率(ORR),mDOR為9.2個月。Rucaparib獲得FDA的孤兒藥、加速審批、優先審批、突破性藥物地位。
EMA新批準藥物
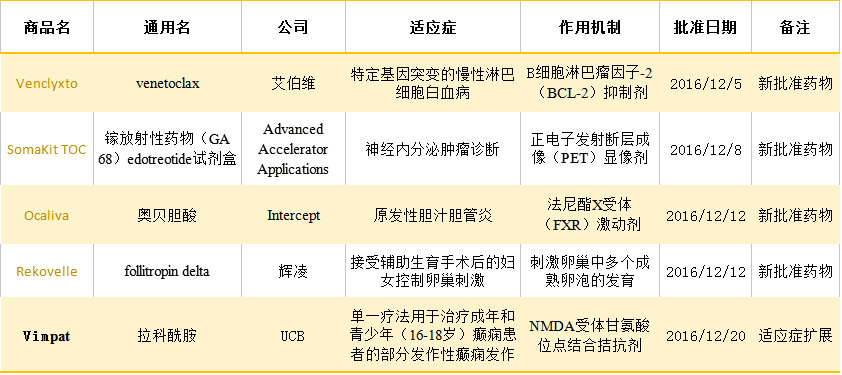

Ocaliva(奧貝膽酸片劑,5mg、10mg)是鵝去氧膽酸的結構修飾物6-乙基鵝去氧膽酸,它是Intercept制藥開發的一種法尼酯X受體激動劑,可通過活化法尼醇X受體,間接抑制膽酸生物合成的限速酶細胞色素7A1(CYP7A1)的基因表達,進而抑制膽酸合成,可用于治療原發性膽汁性膽管炎(PBC)和非酒精性脂肪性肝病(NASH)。2016年5月27日FDA正式批準奧貝膽酸治療原發性膽汁性膽管炎孤兒藥適應癥,可以與熊去氧膽酸聯合治療成人PBC或對熊去氧膽酸不能耐受的單一治療。該藥是近20年來批準的首個治療PBC藥物。據說諾華和Gilead對于收購Intercept比較感興趣。
日本新批準藥物
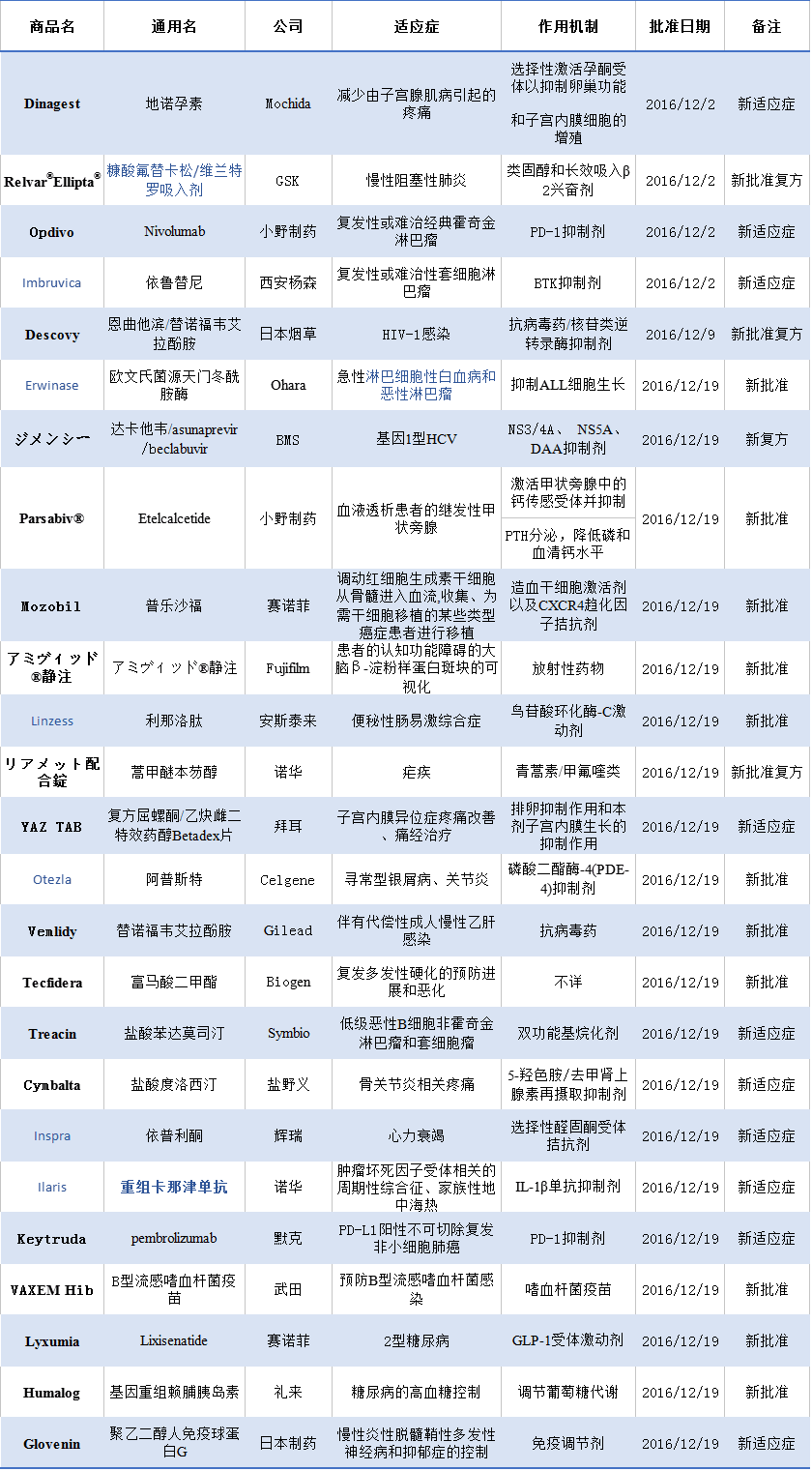

Gilead制藥的Vemlidy(替諾福韋艾拉酚胺,25mg)是一種創新型、靶向性、Tenofovir(替諾福韋)前藥,與之前300mg的Viread(TDF)相比,只需要少于十分之一的劑量便可獲得相似的抗病毒效用。臨床數據顯示,新批準的Vemlidy具有更大的血漿穩定性,同時能夠更有效地將替諾福韋遞送給肝細胞,由于用藥劑量可以更低,從而可以降低血液中替諾福韋的濃度,與Viread相比,Vemlidy能夠更有效改善患者腎臟和骨骼的安全性參數。Vemlidy是在近十年內被批準用于治療這種疾病(慢乙肝)的第一個藥物。

分享到:














 相關新聞
相關新聞