EMA“優(yōu)先藥物”資格認定實施1年概況:申請成功率22%
歐洲藥品管理局(EMA)2016年3月7日開始正式推出“優(yōu)先藥物(Priority Medicines,PRIME)”計劃,主要授予那些針對醫(yī)療需求未得到滿足的疾病,能夠比現有藥物提供更明顯的治療優(yōu)勢或者能夠為無藥可用的患者提供潛在臨床獲益的藥物。EMA實施PRIME計劃的目的是幫助患者盡可能早地獲得能夠顯著改善其生活質量的新藥。
“優(yōu)先藥物”與FDA的“突破性藥物(Breakthrough Therapies)”的出發(fā)點相似,不過FDA的“突破性藥物”認定主要針對嚴重或致死性疾病的藥物,而且要求在某一重要臨床終點上必須比現有藥物更有優(yōu)勢,認定條件似乎比“優(yōu)先藥物”更為嚴格一些。
一個藥物一旦被授予"優(yōu)先藥物"資格,EMA將采取以下措施加快藥物的開發(fā)進度:
1、委派來自人用藥品委員會(CHMP)的專員為研發(fā)企業(yè)提供持續(xù)的技術支持,與企業(yè)溝通提交上市申請前的一切技術問題。如果藥物同時被認定為先進治療藥物,EMA則會委派來自先進治療藥物委員會(Committee on Advanced Therapies,CAT)的成員。
2、組織CHMP/CAT專員、EMA多學科專家小組及相關方召開啟動會議,為藥物的總體研發(fā)方案和注冊策略提供指導。
3、可以為企業(yè)安排與EMA溝通的專屬時點。
4、在關鍵的研發(fā)里程碑為企業(yè)提供科學建議,與更多的利益相關方(如健康技術評估組織)接洽以幫助患者更早獲得新藥。
5、在提交上市申請時與企業(yè)確認獲得加速審評的可能性。
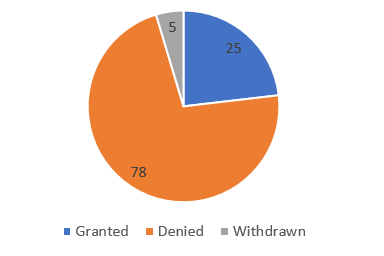
從2016年4月開始,企業(yè)開始陸續(xù)向EMA申請“優(yōu)先藥物”資格。截至2017年5月28日,EMA共收到企業(yè)“優(yōu)先藥物”申請108項,其中授予25項,拒絕授予78項,不符合范圍5項。
“優(yōu)先藥物”認定申請及授予情況
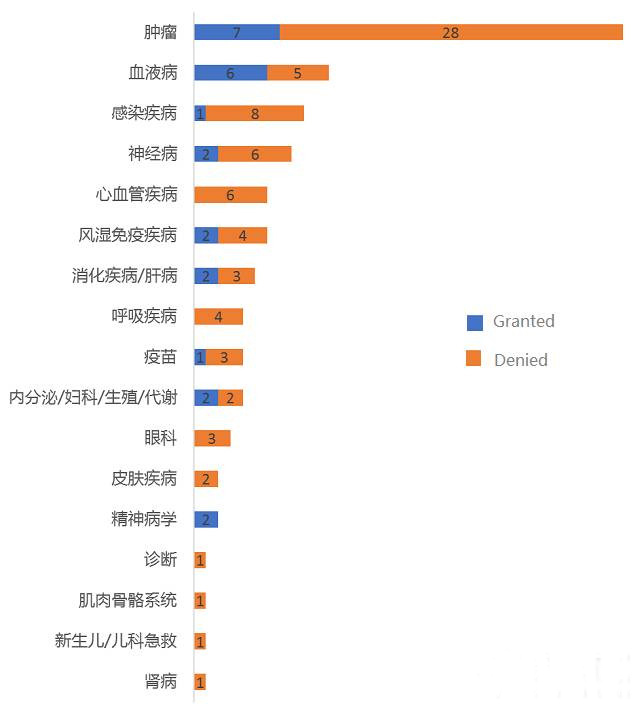
“優(yōu)先藥物”申請的疾病領域分布情況
EMA在5月中旬剛剛發(fā)布了《PRIME The first 12 months》的簡要分析報告,在PRIME落地實施的前12個月(2016年4月~2017年4月),共有96個藥物向EMA提出“優(yōu)先藥物”申請,最終獲得EMA認定的有20項(成功率22%),其中1/3是用于無任何有效治療藥物的疾病。71項申請被拒絕,原因主要有以下方面:
1、70%的申請存在數據不充分的情況。
2、40%的申請無法證明比現有療法有顯著的臨床優(yōu)勢。
3、20%的申請過于超前
5月24日,EMA最新公布了5款獲得認定的“優(yōu)先藥物”,比較值得一提的是治療膠質母細胞瘤的APG101。膠質母細胞瘤是最常見的惡性腦部腫瘤,治療后復發(fā)概率高,5年生存率低于35%。
EMA 5月24日授予優(yōu)先藥物認定的5款新藥
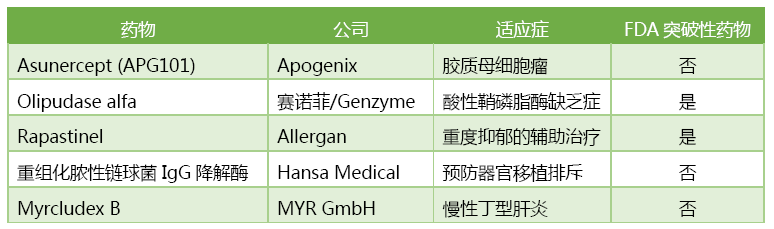
APG101是一款由總部位于德國海德堡的Apogenix公司開發(fā)的腫瘤免疫治療藥物,是由CD95受體胞外結構域和IgG1抗體Fc段組成的全人源融合蛋白,可以與腫瘤細胞表面的CD95結合,阻斷腫瘤細胞生長。在一項納入86例復發(fā)性膠質母細胞瘤患者的II期研究中,APG101可顯著延長患者生存期,EMA由此授予了APG101“優(yōu)先藥物”資格。EMA正是基于這項研究授予了APG101“優(yōu)先藥物”資格。
獲得“優(yōu)先藥物”認定后,Apogenix公司可以與EMA有更早期的密切接觸,獲得臨床試驗設計的優(yōu)化意見,有利于獲得高質量的研究數據,也有利于讓這款臨床急需的藥物早日上市以造福患者。

分享到:









 相關新聞
相關新聞