FDA將優先接受超過100種突破性仿制藥的申請
為了降低藥價,美國食品藥品管理局FDA正在采取一項務實的方式,將接受超過100種仿制藥的申請(ANDA),即使不進行任何事先的溝通。
這些仿制藥為稱為“突破性仿制藥(Breakthrough Generics)。
與”突破性療法(Breakthrough Therapy)一樣,這些仿制藥的審評審批將獲得FDA的優先對待,目的是加快治療罕見病和其他未滿足的臨床需要。
被指定為“突破性仿制藥”的品種的廠家將獲得FDA的加速審評和雙向溝通, 此外,高級審評人員還將參與跨學科的審評,來加速審評批準這些突破性仿制藥。
由于這些品種通常競爭不足,有不到三種競品,因此,藥價居高不下。采取鼓勵仿制藥的措施是為了增加競爭,借此降低藥價。
FDA最近公布了含有146個品種(ANDA)的目錄。最受關注的是以下的銷售量最多的品種。
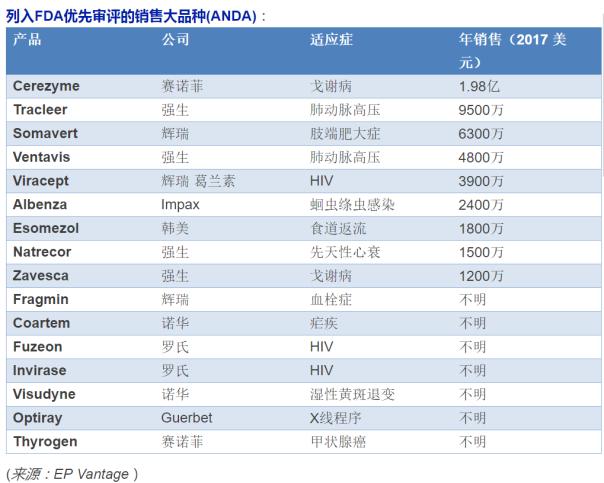
其中,治療戈謝病的暢銷大藥,賽諾菲的Cerezyme雖然有強生的競品Zavesca,但是,預計仍將保持銷量第一的地位。Cerezyme的年平均治療費用為300,000萬美元。
治療肺動脈高壓的強生的Tracleer位居銷量第二位,足以顯示這個市場的潛力。目前,口服Tracleer的治療成本為2,970美元一月。
市場力量:降價同時有利創新
除了加速審評審批突破性仿制藥以外,FDA還在召開公開會議,更好地管理仿制藥批準程序,以確保進口較便宜的藥物,同時這樣做仍然有利于創新。
這也從側面反映了FDA對待藥價的思路。這個想法是通過市場的力量來加速競爭,從而達到降低藥價的目的。
尤其是對于一些罕見疾病。這是因為,專利持有人對仿制藥廠商嚴格控制,讓其不能獲得進行生物等效性評價的數據。
與以量換價,直接降低藥價的做法相比,這個措施是否奏效還有待觀察。
大批治療罕見病的暢銷藥過了專利期卻沒有競爭對手,這一大藥企不愿告人的秘密能改變嗎?

分享到:









 相關新聞
相關新聞