一致性評價(jià)之眾生百態(tài)
仿制藥質(zhì)量和療效一致性評價(jià)無疑是當(dāng)下國內(nèi)制藥行業(yè)最熱門的話題,牽動著整個(gè)行業(yè)的神經(jīng)。一致性評價(jià)是還歷史欠債,提升國內(nèi)藥品質(zhì)量,對人民健康和行業(yè)發(fā)展大有裨益,可以用“功在當(dāng)代,利在千秋”來形容,其目的和意義勿須多言。然而在整個(gè)行業(yè)真正開始“撥亂反正”的時(shí)候,行業(yè)各方卻又面臨各種問題和困難,可謂眾生百態(tài)。
面對這緊迫的歷史任務(wù),各級政府部門(尤其是藥監(jiān)部門)、一致性評價(jià)工作的參與主體(外資藥企、國有藥企、民營藥企)、行業(yè)供應(yīng)商(CRO,制藥設(shè)備儀器、原輔料包材、各類耗材廠商)、培訓(xùn)機(jī)構(gòu)……等行業(yè)參與者都在想些什么,忙些什么呢?在分析之前,我們先簡單梳理一下一致性評價(jià)工作的來龍去脈。
2012年2月13日,國務(wù)院印發(fā)了《國家藥品安全“十二五”規(guī)劃》,明確提出“部分仿制藥質(zhì)量與國際先進(jìn)水平存在較大差距”,而且“未通過質(zhì)量一致性評價(jià)的不予再注冊,注銷其藥品批準(zhǔn)證明文件”。
有了問題就要解決,于是2012年11月22日,CFDA發(fā)布《關(guān)于征求<仿制藥質(zhì)量一致性評價(jià)工作方案(征求意見稿)>意見的通知》,向社會公開征求意見,并于2013年2月發(fā)布正式文件。其中指出對2007年修訂的《藥品注冊管理辦法》實(shí)施前批準(zhǔn)的仿制藥,分期分批與被仿制藥進(jìn)行質(zhì)量一致性評價(jià),在2015年前完成基本藥物目錄中固體口服制劑質(zhì)量一致性評價(jià)的工作任務(wù)。
2013年7月,部署包括中檢院在內(nèi)的多個(gè)省市藥檢所承擔(dān)75個(gè)藥品的方法研究工作。但是后續(xù)也沒有看到多少進(jìn)展了,這項(xiàng)工作給外界的總體印象是:雷聲大,雨點(diǎn)小。于是,企業(yè)也就沒當(dāng)回事了。
2014年,《三聯(lián)生活周刊》特邀撰稿人袁越(網(wǎng)名“土摩托”)在媒體上以《中國人為什么吃不到新藥》、《國產(chǎn)藥質(zhì)量為何上不去》、《進(jìn)口藥為什么那么慢》以及《國產(chǎn)藥的質(zhì)量差在哪里》為題給廣大人民群眾描述了中國藥品審評審批的現(xiàn)狀:審查效率低,日常監(jiān)管松,造成的后果是新藥和好藥給不到病患,從一定程度上加劇了醫(yī)患矛盾。
不知道該系列文章是不是對促使上層決策者痛下決心提高藥品監(jiān)管能力有那么一點(diǎn)點(diǎn)推動作用,但不管怎么說,很短時(shí)間之后的2015年,我們迎來了疾風(fēng)驟雨一般的藥品監(jiān)管改革。堅(jiān)決推進(jìn)仿制藥質(zhì)量和療效一致性評價(jià)工作便是其中之一。
2015年8月18日,由國務(wù)院印發(fā)的《關(guān)于改革藥品醫(yī)療器械審評審批制度的意見》里,將“提高仿制藥質(zhì)量,加快仿制藥質(zhì)量一致性評價(jià)”作為改革藥品審評審批制度的五大目標(biāo)之一。當(dāng)前階段的具體任務(wù)是2018年底要完成2007年10月1日前批準(zhǔn)的《國家基本藥物目錄》中化學(xué)藥品仿制藥口服固體制劑的質(zhì)量一致性評價(jià)。
根據(jù)《國務(wù)院辦公室關(guān)于開展仿制藥質(zhì)量和療效一致性評價(jià)的意見》國發(fā)辦(2016)8號,“化學(xué)藥品新注冊分類實(shí)施前批準(zhǔn)上市的其他仿制藥,自首家品種通過一致性評價(jià)后,其他藥品生產(chǎn)企業(yè)的相同品種原則上應(yīng)在3年內(nèi)完成一致性評價(jià);逾期未完成的,不予再注冊。”另外“同品種藥品通過一致性評價(jià)的生產(chǎn)企業(yè)達(dá)到3家以上的,在藥品集中采購等方面不再選用未通過一致性評價(jià)的品種。”
在一致性評價(jià)工作上升到國務(wù)院指定完成工作的高度后,各企業(yè)之間又面臨競賽,先通過者給予優(yōu)待,沒通過者直接關(guān)門,一下子打醒了原本還想蒙混過關(guān)的人。到如今,一致性評價(jià)對于制藥企業(yè)已經(jīng)不是做與不做的問題,而是如何制定最優(yōu)策略從這輪市場洗牌中存活或者勝出的問題。
下面,我們來分析一下行業(yè)各方在一致性評價(jià)中扮演的角色、發(fā)揮的作用、面臨的問題……希望幫助大家對一致性評價(jià)有更全面深入的了解。
政府機(jī)構(gòu)
在2015年8月國務(wù)院發(fā)文拉開“一致性評價(jià)”大幕之后,CFDA如同注入了無限能量,像一臺高速運(yùn)轉(zhuǎn)的永動機(jī),藥監(jiān)局老師加班加點(diǎn)發(fā)布了一系列征求意見稿并很快公布正式稿,涉及評價(jià)工作程序、評價(jià)品種分類、參比制劑選擇認(rèn)定和獲取、企業(yè)備案公開、改鹽改酸根改劑型改規(guī)格等特色產(chǎn)品評價(jià)原則、生物等效臨床有效評價(jià)標(biāo)準(zhǔn)以及臨床研究基地資源、研發(fā)和生產(chǎn)現(xiàn)場核查指導(dǎo)原則、申報(bào)資料撰寫和提交要求等等,給大家布置了大量作業(yè),可以說讓人目不暇接。
雖然發(fā)布了很多通知和公告,但是大家的理解能力參差不齊,解讀方式也存在差異,于是藥監(jiān)局老師覺得還是得給大家上上課,把大家的認(rèn)識盡量拉到一個(gè)水平上來。于是國家總局2016年7月-9月輾轉(zhuǎn)8個(gè)省(浙江、江蘇、山東、廣東、四川、河北、黑龍江和甘肅)開展仿制藥質(zhì)量和療效一致性評價(jià)培訓(xùn),受到熱烈追捧,場場爆滿。雖然培訓(xùn)內(nèi)容基本一樣,但有不少人參加了不止一場。現(xiàn)場問答環(huán)節(jié)多集中在參比制劑選擇和認(rèn)定、豁免臨床標(biāo)準(zhǔn)、審評要求等關(guān)鍵信息,很多問題培訓(xùn)老師都只是說在研究制定中,等待后續(xù)公告,同時(shí)也收到很多新的問題,也是要帶回去細(xì)細(xì)研究的。因此,這一輪下來,大家都認(rèn)識到任務(wù)的緊迫性,卻仍然覺得無從下手。而藥監(jiān)部門也感受到了來自業(yè)界的壓力,認(rèn)識到出臺實(shí)施細(xì)則指導(dǎo)企業(yè)開展具體工作的緊迫性。
聽取行業(yè)意見和制定各種流程制度已經(jīng)耗費(fèi)了CFDA大量的時(shí)間精力,想想未來兩三年還有那么多申報(bào)資料送上來,而且必須快速完成審評審批……解決前幾年積壓下來的2萬多件申請都已經(jīng)力不從心了,審評老師即使個(gè)個(gè)是千手觀音也不夠應(yīng)付一致性評價(jià)工作啊……為了盡快解決申請積壓,提高審評效率和質(zhì)量,也為了更好地與申請企業(yè)溝通,除了應(yīng)對眼下的一致性評價(jià)申請,更是著眼于未來藥品申請審評審批良好生態(tài),藥審中心大張旗鼓招入了大量人才,有編內(nèi)和編外,也有應(yīng)屆和社會人員,有專職審評和項(xiàng)目管理,可以說隊(duì)伍越來越龐大,也越來越規(guī)范。
國家局忙忙碌碌,省局也緊跟步伐。除了傳達(dá)國家局的精神,省局也在排摸省內(nèi)家底情況,時(shí)時(shí)督促企業(yè)定期上報(bào)一致性評價(jià)工作進(jìn)展,了解遇到的困難,并著力幫助解決。
除了最為忙碌的國家食藥監(jiān)總局,各省局和其他部委也積極參與其中,衛(wèi)計(jì)委、工信部、人社部等也在配合制定相關(guān)規(guī)章制度和工作流程,特別是通過一致性評價(jià)的品種在醫(yī)保、定價(jià)等方面提供優(yōu)惠政策,給積極響應(yīng)努力工作的企業(yè)以切切實(shí)實(shí)的回報(bào)。
對地方政府而言,制藥行業(yè)是非常重要的經(jīng)濟(jì)支柱和財(cái)政來源,也為創(chuàng)新創(chuàng)造和人才就業(yè)提供了很多機(jī)會,因此在藥廠面臨如此重大任務(wù)的時(shí)候,各地政府也愿意提供人力和政策支持,特別是在參比制劑采購、檢驗(yàn)檢測、技術(shù)咨詢、臨床基地等資源上給予快速通道,并切切實(shí)實(shí)拿出一些財(cái)政收入扶持和鼓勵企業(yè)積極開展工作,更要在和其他省市的競爭中不落下風(fēng),并在未來的競爭中取得領(lǐng)先。
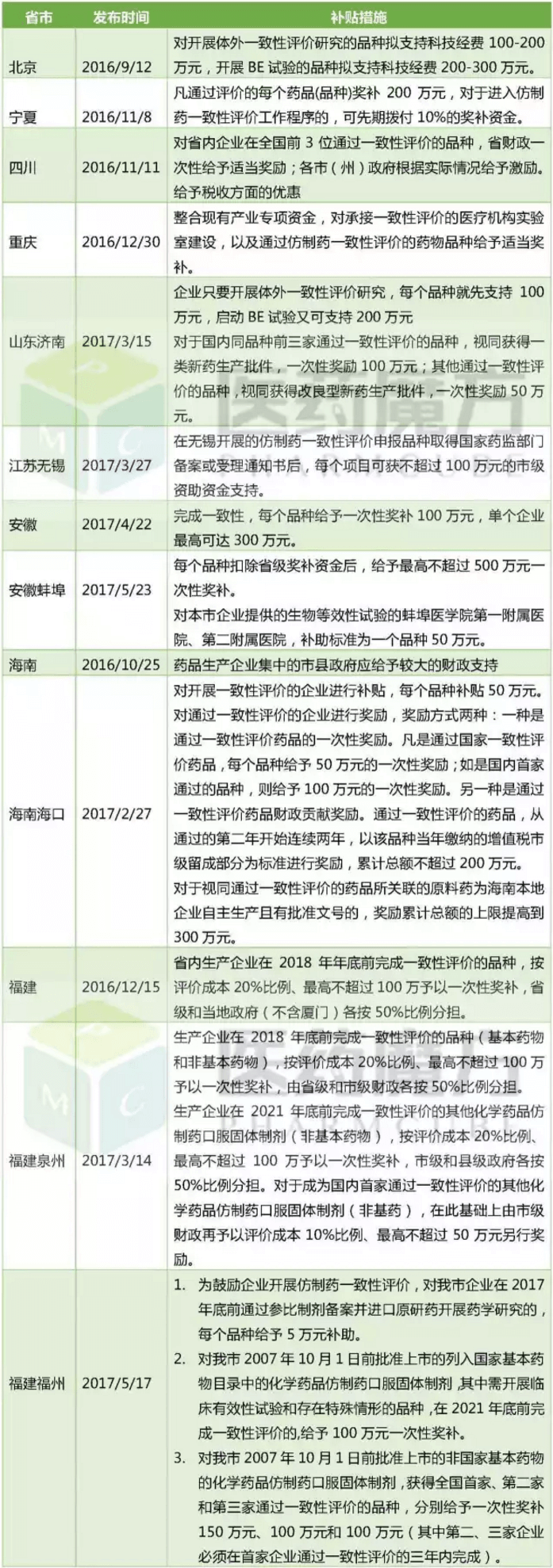
于是,我們可以看到很多省市明確指出對省內(nèi)企業(yè)在全國前3位通過一致性評價(jià)的品種,省市財(cái)政一次性給予適當(dāng)獎勵,這樣一來可以給企業(yè)分擔(dān)一部分費(fèi)用,最高可達(dá)500萬,減輕企業(yè)經(jīng)濟(jì)壓力。
各地資金支持
政府部門忙得熱火朝天,想方設(shè)法引導(dǎo)和幫助企業(yè)完成一致性評價(jià)任務(wù),那作為工作主體的制藥企業(yè)又是作何感想,在忙些啥呢?
制藥企業(yè)
面對一致性評價(jià)任務(wù),時(shí)間緊,要求高,投入大,全國幾千家藥廠,技術(shù)和資金實(shí)力相差懸殊,心態(tài)自然是不一樣的。
先來看看高大上的外資原研藥企。
我國是仿制藥大國,自己創(chuàng)造的新藥很少,大部分的藥品都是外資企業(yè)開發(fā)而后進(jìn)入中國的。國家局認(rèn)定的參比制劑是首選原研進(jìn)口,而對于大部分外資原研藥企來說,第一種情況,在中國上市的產(chǎn)品多為直接進(jìn)口成品或者是進(jìn)口分包裝。這類產(chǎn)品直接申報(bào)作為參比制劑,無須進(jìn)行一致性評價(jià)。第二種情況,國外生產(chǎn)技術(shù)轉(zhuǎn)移到國內(nèi)工廠的本地化產(chǎn)品。外資企業(yè)自身的質(zhì)量體系就要求必須與轉(zhuǎn)出工廠的產(chǎn)品在質(zhì)量上保持一致,有些在華工廠的產(chǎn)品也會出口到包括歐美日在內(nèi)其他國家市場,已經(jīng)申請歐美日等發(fā)達(dá)國家上市許可并獲得批準(zhǔn),本就符合共線產(chǎn)品在歐美日上市這一條件,一般來說都有充足的數(shù)據(jù)支持其質(zhì)量,因此經(jīng)國家局審核作為參比制劑也是合理的。第三種情況,專為中國市場開發(fā)的產(chǎn)品,或者是在進(jìn)入中國早期與國內(nèi)企業(yè)合資,后來國內(nèi)企業(yè)資本完全退出后遺留的本土產(chǎn)品。這類產(chǎn)品無法得到母公司在歐美日發(fā)達(dá)國家工廠的技術(shù)支持而成為外資企業(yè)在華工廠不得不面臨的難題,這種情況下就和國內(nèi)企業(yè)沒啥差別了。對于這類產(chǎn)品,也要有所區(qū)分,一是有些也是長期不生產(chǎn)或者生產(chǎn)的很少很少,這種情況下往往就會舍棄,二是有些產(chǎn)品為中國業(yè)績帶來巨大貢獻(xiàn),這就需要花大力氣保住了,這類產(chǎn)品不多,但只要有那么一兩個(gè),就足夠苦惱了。畢竟外資企業(yè)在華工廠的優(yōu)勢在于精益生產(chǎn)和質(zhì)量管理,而在脫離母公司在歐美日發(fā)達(dá)國家工廠的技術(shù)支持的前提下,產(chǎn)品藥學(xué)開發(fā)相比國內(nèi)企業(yè)并沒有特別的優(yōu)勢。
外資仿制藥企業(yè)的情況也是類似。
外資仿制藥企業(yè)在國內(nèi)很少建工廠,即使有,很多也退出了,現(xiàn)存國內(nèi)上市的品種多為進(jìn)口仿制藥,如果本就在歐美日上市了,那也可以有充足數(shù)據(jù)證明自己質(zhì)量過硬。而剩下的這些,要么證明當(dāng)初進(jìn)入中國的時(shí)候做的臨床研究是完全合規(guī)的,要不然也不得不加入一致性評價(jià)的大潮。
所以總體來看,外資企業(yè)在面對一致性評價(jià)任務(wù)的時(shí)候還是不慌不忙的,畢竟工作在前面已經(jīng)做好了,而且大多數(shù)也嚴(yán)格合規(guī)生產(chǎn),產(chǎn)品質(zhì)量用不著過多擔(dān)憂。
接下來再看看國內(nèi)企業(yè)。
國內(nèi)企業(yè)原本一直是處于觀望狀態(tài),但是眼看這通知公告發(fā)布如此之頻繁,條件要求如此之嚴(yán)格,不按期完成的后果如此之嚴(yán)重,只好硬著頭皮組織力量進(jìn)行攻關(guān)。當(dāng)然,也有一些企業(yè)竊喜,這是一次大洗牌,甚于新版GMP改造的大洗牌,機(jī)遇來了。以往在定價(jià)和招投標(biāo)中給一個(gè)藥品質(zhì)量分級依據(jù)的指標(biāo)是廠家產(chǎn)值排名、GMP等級、新藥證書(首仿)、獲獎情況(首仿填補(bǔ)空白)等,而忽略了產(chǎn)品本身的質(zhì)量是不是與原研產(chǎn)品一致。于是就出現(xiàn)了袁越在文中提到的“夏天吃國產(chǎn),冬天吃進(jìn)口”和“開始吃進(jìn)口,平穩(wěn)后吃國產(chǎn)”這樣的醫(yī)囑。應(yīng)該說這樣的現(xiàn)狀大家都知道,一致性評價(jià)的意義也都明白,但要擼起袖子干起來的時(shí)候,心情是大不一樣的。
先說說國企。由于歷史原因,國企是首批289個(gè)必須完成一致性評價(jià)品種的大戶。一些“國退民進(jìn)”改制為民營企業(yè)的藥廠也有很多品種在此范圍內(nèi)。國企生產(chǎn)供應(yīng)基本藥物目錄中的產(chǎn)品,尤其是這289個(gè)藥品,不僅僅是一種生產(chǎn)經(jīng)營經(jīng)濟(jì)行為,也同樣承擔(dān)著國家戰(zhàn)略物資供應(yīng)儲備的責(zé)任。因此國企領(lǐng)導(dǎo),特別一些集團(tuán)國企的老總承受著很大壓力,手里有幾百個(gè)生產(chǎn)批件,雖然不少都束之高閣在睡大覺,但畢竟都是無形資產(chǎn),都是可以引以為豪的財(cái)富。然而風(fēng)云突變,現(xiàn)在都成了燙手山芋。
按照現(xiàn)在的行情,完成一個(gè)品種的一致性評價(jià)工作的費(fèi)用是大幾百萬元,有些集團(tuán)企業(yè)手上有幾十個(gè)品種屬于289產(chǎn)品,時(shí)間緊迫,但是資源又十分有限,這就十分頭疼了。這個(gè)時(shí)候不得不分清主次,丟車保帥,把產(chǎn)量大、利潤高、難度可把握的產(chǎn)品優(yōu)先安排,其余那些難度大、很少生產(chǎn)的產(chǎn)品只能在精力剩余的情況下再做打算。
不過國企最不缺的就是上級單位協(xié)調(diào)安排之下可以得到兄弟單位的支持。2017年01月09日在上海市科委的推動下,經(jīng)過前期協(xié)商,上海醫(yī)藥與八家三甲醫(yī)院本著強(qiáng)強(qiáng)聯(lián)合、資源互補(bǔ)、互惠互利的原則達(dá)成共識,將在新藥臨床研究、仿制藥一致性評價(jià)的生物等效性試驗(yàn)等方面開展多方面合作,目前已確定了32個(gè)品種的生物等效性合作意向。
再看那些財(cái)大氣粗的民營企業(yè)。相較于國企,民營企業(yè)更加靈活,特別是那些財(cái)大氣粗的金主,做法更加大膽而且也實(shí)實(shí)在在愿意投入。一方面招兵買馬擴(kuò)大研發(fā)隊(duì)伍,同時(shí)也尋找外部研發(fā)資源,藥學(xué)開發(fā)和臨床研究委托多家公司;另一方面,另辟蹊徑“出口轉(zhuǎn)內(nèi)銷”,先在歐美日等發(fā)達(dá)國家申請上市再回到國內(nèi)申請視同通過一致性,這些企業(yè)往往早在幾年前就啟動這項(xiàng)工作,“早起的鳥兒捉蟲多”,有膽識,有實(shí)力;有些也選擇收購?fù)獠考夹g(shù),如已經(jīng)獲得美國FDA認(rèn)證的ANDA技術(shù)包;或者干脆收購國外有ANDA證書的工廠,再技術(shù)轉(zhuǎn)移到國內(nèi)工廠后申請歐美等發(fā)達(dá)國家的上市許可,最后回到國內(nèi)申請共線產(chǎn)品視同通過一致性,這種操作整個(gè)周期也不短,但是成功率更高。如此一來,霸氣十足,多管齊下,可以把其他中小型企業(yè)甩在身后,同時(shí)也是新一輪搶占地盤。
最苦的莫過于那些靠幾個(gè)老品種支撐的中小型企業(yè)。前幾年砸鍋賣鐵好不容易通過新版GMP認(rèn)證,花掉了好幾年的利潤,正準(zhǔn)備慢慢恢復(fù)積攢些收入,一致性評價(jià)又一次把企業(yè)推到了生死存亡的邊緣。如同新版GMP認(rèn)證一樣,不去做,三五年后就是死,硬著頭皮去做,幾年的利潤都得投進(jìn)去,不知道哪一年可以恢復(fù)元?dú)狻_€有些小企業(yè),都是靠幾個(gè)老品種過日子,已經(jīng)不知道多少年沒有上新品種了,根本沒有研發(fā)能力,所以遇到這種情況,只能委托外包,可是眼下的評價(jià)費(fèi)用又高到不能接受。
有些企業(yè)原本既有注射劑又有口服固定制劑,在新版GMP認(rèn)證前痛下決心舍棄了其中一種劑型,現(xiàn)在又是不同的心情:放棄口服固體制劑生產(chǎn)線的,當(dāng)初改造注射劑生產(chǎn)線花了更多的錢,眼下覺得還是有些慶幸的;而放棄注射劑生產(chǎn)線的企業(yè),發(fā)現(xiàn)剛填平一個(gè)大坑,后面又來一個(gè)天坑,感覺真是“嗚呼哀哉,前途在哪里,是不是大環(huán)境如此就是要亡我”。這類企業(yè)要么干脆整體出售,或者引入融資貸款,或者找合作方共同完成一致性評價(jià)后期利益分成。總之,得絞盡腦汁才能存活下去。
供應(yīng)商
與制藥企業(yè)有人歡喜有人憂不同,一致性評價(jià)之下的各類供應(yīng)商卻發(fā)現(xiàn)了大量商機(jī),興奮得不得了。
仿制藥質(zhì)量和療效一致性評價(jià),其中一個(gè)關(guān)鍵指標(biāo)是溶出度。評價(jià)溶出度,自然離不開溶出儀。為了規(guī)范溶出儀的性能,專門出臺了《藥物溶出度儀機(jī)械驗(yàn)證指導(dǎo)原則》,有些陳舊的儀器很難通過校驗(yàn),不得不淘汰。此外,工作量的增加也可能造成儀器排不開來。所以首當(dāng)其沖的是溶出儀生產(chǎn)商訂單增多,維修工程師也更加忙碌。
溶出儀是測定溶出度,而影響溶出度的包括制藥設(shè)備和原輔料。就工序而言,制粒、混合、壓片等都會對溶出度產(chǎn)生重大影響,用到的設(shè)備包括高剪切濕法制粒機(jī)和流化床等就顯得尤為關(guān)鍵了。有些廠家財(cái)大氣粗,舍得買進(jìn)口設(shè)備性能更加穩(wěn)定,有些廠家限于資金壓力,還是選擇國產(chǎn)品牌。現(xiàn)在國產(chǎn)品牌也在迎頭趕上,特別是原先制劑研發(fā)背景的科研人員開發(fā)改進(jìn)的設(shè)備更了解如何配合處方工藝開發(fā),在整個(gè)研發(fā)生態(tài)體系中屬于另辟蹊徑,是一個(gè)非常好的選擇。
除了設(shè)備,原輔料的性質(zhì)也和溶出度有密不可分的關(guān)系,原料藥的粒徑、晶型,輔料的質(zhì)量也會影響溶出度。因此現(xiàn)在制劑工廠面臨的問題,也會倒逼原輔料廠商提高產(chǎn)品質(zhì)量。制劑廠家也開始愿意多花些錢采購質(zhì)量更好的物料,進(jìn)口輔料的生意也會好起來。
上述物資還是好解決的,采購目標(biāo)都很明確,只要舍得花錢,可以有很多合法途徑獲得的。但是有一項(xiàng)物資就讓很多人發(fā)愁了,那就是參比制劑。為什么發(fā)愁呢?第一個(gè)原因就是買哪個(gè)公司生產(chǎn)的?這可是一致性評價(jià)工作開展的根基,目標(biāo)必須明確,一旦仿制對象選擇錯(cuò)誤,那就意味著前功盡棄。所以這個(gè)話題也引起了業(yè)內(nèi)的大討論,特別是一些產(chǎn)品被持有人幾經(jīng)交易,讓國人很難追溯哪家是最早的廠商。當(dāng)然,很多熱心人士不僅整理了信息檢索的各類路徑方法,也有人就個(gè)別案例仔細(xì)深究激起了熱烈反響,魔方還提供了參比制劑的數(shù)據(jù)庫供大家參考。第二個(gè)困難就是怎么獲得。國家局認(rèn)定的參比制劑多為在歐美日工廠生產(chǎn),如果已經(jīng)在我國進(jìn)口上市,那還好獲得,而對于那些尚未在我們上市的原研藥,就需要在海外尋找供貨商。
參比制劑以前都是屬于私下代購,對于少量需求如此操作尚可,但現(xiàn)在需求量顯著上升,一方面很多廠家不得不投入到一致性評價(jià)的工作中,另一方面是對廠家參比制劑的分析研究工作也是審評中非常重要的一塊內(nèi)容。此外,國家局也對獲取參比制劑的手續(xù)資質(zhì)也明確了要求。也有人看到這部分商機(jī),專門從事海外參比制劑的合法代購,收獲不小。
服務(wù)行業(yè)
面對突如其來的一致性評價(jià)任務(wù),大部分企業(yè)是應(yīng)付不過來的。不僅需要滿足體外溶出一致,還要達(dá)到體內(nèi)生物等效。如果說藥學(xué)開發(fā)部分有些企業(yè)還勉強(qiáng)能顧應(yīng)付,那生物等效就讓大部分企業(yè)感到陌生和力不從心。因此無論是藥學(xué)開發(fā)還是生物等效,甚至是臨床有效性研究的技術(shù)服務(wù)公司,我們習(xí)慣稱為CRO,就一下子眼中放光,嗅到了巨大的商機(jī)。
說說行情價(jià)吧。眼下,一個(gè)普通速釋品種,且不是高度變異,藥學(xué)加生物等效普遍報(bào)價(jià)在500萬元以上,加上企業(yè)為此購買設(shè)備儀器和原輔料,所需投入可能要接近千萬級別。據(jù)說某領(lǐng)先CRO,藥學(xué)加臨床整體報(bào)價(jià)都達(dá)到1500萬元,讓人瞠目結(jié)舌。
于是有證券投資基金等領(lǐng)域的醫(yī)藥行業(yè)研究人士開始估算這塊蛋糕有多么巨大了,最為夸張的是把所有化學(xué)藥品中口服固體制劑的生產(chǎn)批件全部拿出來,再按一個(gè)品種的行情價(jià)計(jì)算,這個(gè)數(shù)字是絕對驚人。近期,國家局又發(fā)布消息,注射劑的再評價(jià)工作也要啟動了,這個(gè)數(shù)字會越發(fā)驚人。
其實(shí)這種算法是過于夸大了,首先這么多生產(chǎn)批件其實(shí)真正投產(chǎn)的可能只有三分之一不到,很大一部分生產(chǎn)批件根本無力無心去保,會自然消亡的,不會給CRO行業(yè)帶來利益,其次有些產(chǎn)品是免于生物等效或者視同通過一致性評價(jià),還有一些產(chǎn)品是規(guī)格不同而等比例放大,只需要做一個(gè)規(guī)格即可。當(dāng)然,我們還是不能否認(rèn)仿制藥質(zhì)量和療效一致性評價(jià)任務(wù)給CRO行業(yè)是帶來了很多很多生意,畢竟原本根本沒有產(chǎn)品開發(fā)預(yù)算或者預(yù)算相當(dāng)?shù)偷钠髽I(yè)也不得不掏出很多錢來,以及前文提到的各地政府給予的一些補(bǔ)貼。
正是因?yàn)榭吹搅诉@塊大蛋糕,眾人摩拳擦掌想分一杯羹,于是各種一致性評價(jià)平臺、藥物評價(jià)中心、仿制藥開發(fā)一站式服務(wù)平臺等如雨后春筍一般冒出來,其中有些是原先的CRO公司在市場推廣時(shí)便于宣傳,也有些是幾個(gè)人或幾家公司拉著投資方或者是當(dāng)?shù)貓@區(qū)合伙新建,畢竟當(dāng)?shù)卣蛨@區(qū)也樂于整合資源從而服務(wù)當(dāng)?shù)氐乃帍S。
另外隨著國家局對臨床研究真實(shí)性、規(guī)范性和數(shù)據(jù)可靠性的嚴(yán)肅整頓,各個(gè)臨床基地也忙于各類自查和核查,無心承接新的研究任務(wù),造成新的瓶頸。為了破除臨床基地資源瓶頸,現(xiàn)在GCP審查也放開改為備案制,也鼓勵民營資本進(jìn)入,所以我們也看到各地也開始興起籌建新的生物等效研究基地。如果臨床CRO可以擁有自己的臨床基地,那對生意是可以起到?jīng)Q定性作用的。
說到臨床基地在整改的過程中,也需要更好的供應(yīng)商幫助改善受試者招募、試驗(yàn)樣品保存分配、研究過程的管理等等,在這種情況下,電子數(shù)據(jù)采集系統(tǒng)EDC也開始受到更多關(guān)注,不少國外軟件開發(fā)商也瞅準(zhǔn)機(jī)會把更加成熟的系統(tǒng)帶到中國。還有就是,操作規(guī)范的臨床樣品配送服務(wù)商也看到了機(jī)遇。
除了這些做實(shí)業(yè)的生意之外,還有一些生意也是可以撈一筆的。比如ANDA技術(shù)包轉(zhuǎn)讓。國外已經(jīng)上市的仿制藥的生產(chǎn)技術(shù),大家還是很感興趣的,畢竟這樣總比自己搗鼓來的更加保險(xiǎn),但這也存在一定風(fēng)險(xiǎn),畢竟原輔料和生產(chǎn)設(shè)備的不同對產(chǎn)品的溶出度、雜質(zhì)和穩(wěn)定性還是有一定影響的,即使拿到技術(shù)包,自己還是要有些摸索才行的。另外,對技術(shù)包的真實(shí)性和完整性也是會有些擔(dān)心的。
其實(shí)外資仿制藥公司在中國都不怎么成功,原因是多方面的。眼下如果還有外資仿制藥公司想進(jìn)入中國,那應(yīng)該是一個(gè)契機(jī),一個(gè)路徑就是將某些品種的生產(chǎn)技術(shù)授權(quán)給中國公司,不見得需要建廠,可以收取一些技術(shù)轉(zhuǎn)讓費(fèi),但更多的是銷售分成。其實(shí)CRO也可以這么操作,前期收取少量技術(shù)服務(wù)費(fèi),雙方風(fēng)險(xiǎn)共擔(dān)共同開發(fā)產(chǎn)品,一方面減輕藥廠經(jīng)濟(jì)壓力,另一方面也是提升雙方合作緊密度調(diào)動CRO積極性,一旦成功,后期獲利共享。
前文也提到過,有些藥廠剛剛闖過了新版GMP認(rèn)證這個(gè)關(guān)卡,又面臨一致性評價(jià)挑戰(zhàn),在這個(gè)節(jié)骨眼上很需要錢,這個(gè)時(shí)候資本就蠢蠢欲動了。新一輪的產(chǎn)品權(quán)益轉(zhuǎn)移和藥廠整合也開始了。經(jīng)過三五年之后,我們會發(fā)現(xiàn)中國的藥廠會更加趨于集團(tuán)化,相互之間的關(guān)系也更加復(fù)雜,“你中有我,我中有你”會越來越明顯。如此一來,可以淘汰低附加值產(chǎn)能,實(shí)現(xiàn)供給側(cè)改革的目的。
最后不得不提一下培訓(xùn)會務(wù)市場。可以說大部分企業(yè)都派人參加過各種各樣的一致性評價(jià)培訓(xùn)會議。在國家局舉辦的巡回宣講之外,各類機(jī)構(gòu)主辦的培訓(xùn)也是眼花繚亂,幾乎每個(gè)月都有好幾場,講課老師其實(shí)都是一班人馬,可能不超過50個(gè)人,講課的內(nèi)容也大同小異。聽得時(shí)候覺得真是太有道理,茅塞頓開,回去之后面對自己承擔(dān)的項(xiàng)目卻發(fā)現(xiàn)還是一大堆問題和困難,無從下手。培訓(xùn)機(jī)構(gòu)一場培訓(xùn)收個(gè)三五千會務(wù)費(fèi),招兩三百個(gè)學(xué)員,扣除幾個(gè)老師的講課費(fèi)和三五個(gè)工作人員的工錢,以及場地費(fèi)和餐食費(fèi),一場下來幾十萬的收入是妥妥的。CRO承接項(xiàng)目還有做砸的風(fēng)險(xiǎn),而培訓(xùn)是穩(wěn)賺不賠。當(dāng)然,這些培訓(xùn)還是有價(jià)值的,行業(yè)內(nèi)同僚聚在一起探討問題,事情才能越辯越明。
結(jié)語
仿制藥質(zhì)量和療效一致性評價(jià)是一件功在當(dāng)代,利在千秋的大事,是尊重?cái)?shù)據(jù),尊重科學(xué)的體現(xiàn)。各個(gè)公司對制劑、化學(xué)和生物分析以及臨床研究人員的追逐也說明了行業(yè)內(nèi)對藥物開發(fā)的認(rèn)識開始回歸本質(zhì)。作為制藥界的從業(yè)者,在這項(xiàng)歷史任務(wù)中找到自己的位置,踏實(shí)鉆研業(yè)務(wù),為老百姓吃到好藥這個(gè)目標(biāo)做出自己的貢獻(xiàn),則無愧于制藥人的使命。
本文來源于網(wǎng)絡(luò),如有侵權(quán)請聯(lián)系我們。

分享到:








 相關(guān)新聞
相關(guān)新聞