世界衛(wèi)生組織(World Health Organization,WHO)是聯(lián)合國下屬的一個(gè)機(jī)構(gòu),其宗旨是使全世界人民獲得盡可能高水平的健康。WHO的主要職能包括:促進(jìn)流行病和地方病的防治;提供和改進(jìn)公共衛(wèi)生、疾病醫(yī)療和有關(guān)事項(xiàng)的教學(xué)與訓(xùn)練;推動(dòng)確定生物制品的國際標(biāo)準(zhǔn)。
在流行病爆發(fā)、自然災(zāi)害國際救援、落后國家人道主義援助等情況下都會(huì)有WHO工作人員的身影,他們最重要的職責(zé)之一是協(xié)調(diào)各方資源進(jìn)行醫(yī)療救助,挽救生命。在這過程中,藥品是必不可少的重要物資。但何種質(zhì)量的藥品是符合WHO工作要求的呢?由于經(jīng)濟(jì)實(shí)力、衛(wèi)生條件和監(jiān)管能力的差別,發(fā)達(dá)國家批準(zhǔn)的藥品不一定適合落后國家,加上藥品監(jiān)管屬于一種國家的主權(quán)范圍,WHO意識(shí)到必須建立一套自己的藥品監(jiān)管系統(tǒng)便于自身在國際行動(dòng)中發(fā)揮更大作用。
為了應(yīng)對(duì)艾滋病在全球范圍內(nèi)的爆發(fā),WHO在2001年建立了藥品預(yù)認(rèn)證制度Prequalification Team: medicines (PQTm),現(xiàn)已更名為Prequalification of Medicines Programme),拉開了WHO獨(dú)立審評(píng)審批藥品的序幕,隨后又陸續(xù)增加了流感、肝炎、瘧疾、結(jié)核病、生殖健康、兒童營養(yǎng)、腹瀉和其他易忽略的熱帶疾病等領(lǐng)域的基本用藥,只有上述領(lǐng)域的藥品基于疾病流行、療效安全性證據(jù)以及性價(jià)比評(píng)估才會(huì)進(jìn)入預(yù)認(rèn)證邀請(qǐng)名錄中,并不是所有藥品都可以申請(qǐng)WHO預(yù)認(rèn)證。認(rèn)證范圍包括制劑、原料藥和獨(dú)立質(zhì)檢實(shí)驗(yàn)室。這樣一來可以基本滿足WHO日常國際行動(dòng)中的普遍需求。
雖然WHO建立了獨(dú)立的藥品審評(píng)審批體系,但還是認(rèn)可發(fā)達(dá)國家藥監(jiān)部門批準(zhǔn)的藥品,WHO將這些部門稱為Stringent Regulatory Authority(SRA)。經(jīng)SRA批準(zhǔn)的藥品,經(jīng)過簡(jiǎn)略審評(píng)就可以進(jìn)入WHO藥品預(yù)認(rèn)證名錄。
一旦獲得WHO藥品預(yù)認(rèn)證,藥企就可以進(jìn)入WHO體系國際采購供應(yīng)商名錄。此外,很多國際性非政府公益組織也認(rèn)可WHO預(yù)認(rèn)證制度,采購認(rèn)證藥品用于人道主義捐贈(zèng)。這對(duì)于藥企來說,可謂名利雙收。當(dāng)然,由于這些藥品都屬于基本用藥且是公益性質(zhì),所以利潤(rùn)相對(duì)而言不會(huì)太多,但采購量巨大,依然可以獲得不小收益。2016年桂林南藥兩個(gè)WHO預(yù)認(rèn)證產(chǎn)品注射用青蒿琥酯銷售收入突破2億元,而鹽酸阿莫地喹+磺胺多辛乙胺嘧啶片銷售收入同樣過億元,是國內(nèi)藥企經(jīng)營WHO市場(chǎng)的佼佼者。
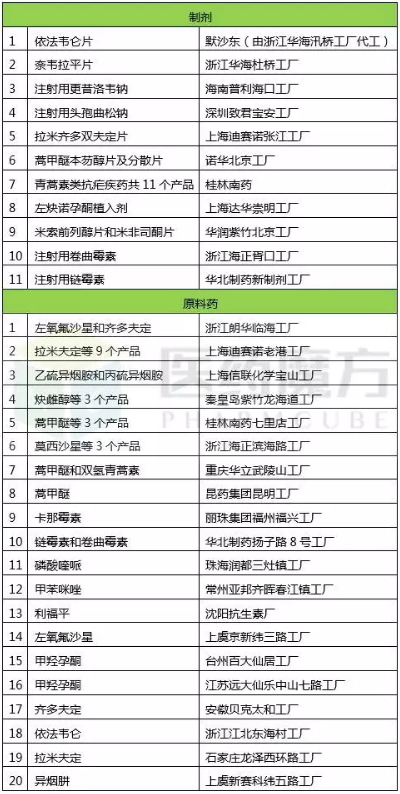
截止2017年8月31日,中國藥廠獲得WHO藥品預(yù)認(rèn)證的品種如下:
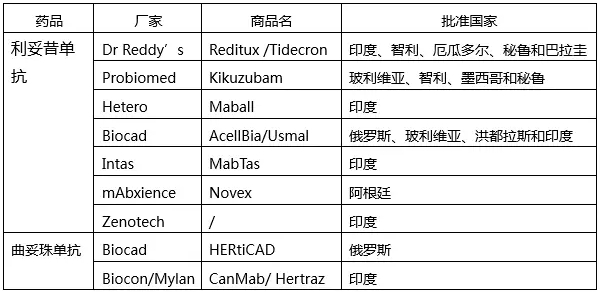
反觀印度藥廠,通過WHO預(yù)認(rèn)證的制劑有20多家,共300多個(gè)產(chǎn)品,遠(yuǎn)超中國;而印度藥廠原料藥約有20家,共約60個(gè)產(chǎn)品,也不遜色于中國。
或許很多人都覺得WHO需要的都是老得掉渣的普藥,雖然量大,但畢竟利潤(rùn)低,累死累活,賺不了大錢,不值得參與。不過,WHO審時(shí)度勢(shì),與時(shí)俱進(jìn),最近盯上了抗體藥物。為了能夠讓最昂貴的癌癥療法在中低收入國家得到更廣泛應(yīng)用,WHO于2017年9月正式啟動(dòng)預(yù)認(rèn)證生物類似物藥品(WHO稱之為Similar Biotherapeutic Products,SBP)試點(diǎn)工作,包括用于治療非霍奇金淋巴瘤和慢性淋巴細(xì)胞白血病的利妥昔單抗和治療乳腺癌的曲妥珠單抗。這兩個(gè)藥品也已經(jīng)收錄在WHO基本藥物目錄中。
申請(qǐng)WHO預(yù)認(rèn)證的廠家根據(jù)藥品批準(zhǔn)情況分成兩類:被SRA批準(zhǔn)上市的藥品;被其他國家藥監(jiān)局(National Regulatory Authority,NRA)批準(zhǔn)上市的藥品。
從中可以讀出兩個(gè)重要信息,首先SRA和NRA是有區(qū)別的,至于區(qū)別是啥,請(qǐng)接著往下看;第二點(diǎn)就是必須是已經(jīng)批準(zhǔn)的藥品,這不僅是因?yàn)閃HO需要NRA的支持,減少工作量和降低風(fēng)險(xiǎn),也是為了出口手續(xù)的必要性。當(dāng)然,WHO也樂意與NRA開展合作,鼓勵(lì)有意愿申請(qǐng)WHO藥品預(yù)認(rèn)證的藥廠也向NRA做出說明,并請(qǐng)求NRA就質(zhì)量評(píng)估過程與WHO合作。同時(shí)WHO也建議申請(qǐng)者也允許NRA就技術(shù)審評(píng)和現(xiàn)場(chǎng)核查與WHO工作人員進(jìn)行討論。
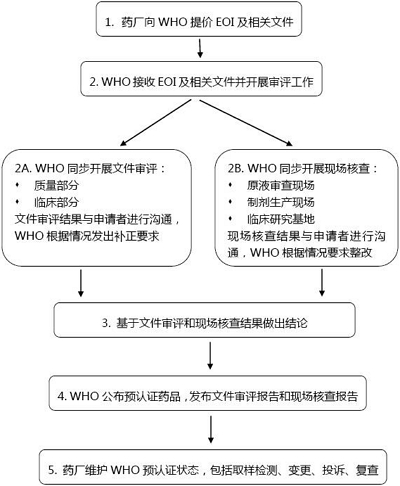
預(yù)認(rèn)證流程通常包括:
1、WHO向工廠發(fā)出邀請(qǐng)(Invitation to Manufacturers);
2、藥廠根據(jù)邀請(qǐng)書要求提交意向文件(Expression Of Interest,EOI),包括1)申請(qǐng)函(Covering Letter);2)CTD格式產(chǎn)品文件(Product Dossier in Common Technical Document format);3)工廠主文件(Site Master File,SMF);4)合同研究組織主文件(Contract Research Organization Master File,CROMF);
3、WHO對(duì)申請(qǐng)文件進(jìn)行形式審查,如果發(fā)現(xiàn)文件缺失,會(huì)通知申請(qǐng)者在規(guī)定時(shí)間內(nèi)補(bǔ)齊,否則退回申請(qǐng);如果文件齊全,WHO會(huì)發(fā)出信函告知文件參考號(hào)(dossier reference number),相當(dāng)于受理號(hào);
4、WHO開展文件審核,主要依據(jù)兩份WHO指導(dǎo)原則(WHO Guidelines onevaluation of similar Biotherapeutic Products (SBPs), Annex 2, Technical ReportSeries No. 977, 2009和WHO Guidelineson evaluation of monoclonal antibodies as similar biotherapeutic products(SBPs), Annex 2, Technical Report Series No. 1004, 2016);WHO希望有NRA代表參與這一過程;
5、WHO依據(jù)GMP、GLP、GCP和WHO建立的SOP,以及質(zhì)量風(fēng)險(xiǎn)管理原則,對(duì)原液和制劑生產(chǎn)現(xiàn)場(chǎng)以及臨床試驗(yàn)基地或CRO開展現(xiàn)場(chǎng)核查;WHO希望有NRA代表參與這一過程;
6、WHO將所有評(píng)估結(jié)果進(jìn)行匯總,經(jīng)討論后作出最終結(jié)論;獲得預(yù)認(rèn)證的藥品將在WHO網(wǎng)站公布;
7、申請(qǐng)者維護(hù)預(yù)認(rèn)證狀態(tài):任何可能影響藥品療效、安全性和質(zhì)量的生產(chǎn)工藝或質(zhì)量控制變更都應(yīng)當(dāng)向WHO提交報(bào)告;向WHO提交藥物警戒計(jì)劃;按照WHO要求開展投訴調(diào)查;原液生產(chǎn)現(xiàn)場(chǎng)三年復(fù)查。
WHO生物類似物藥品預(yù)認(rèn)證流程
如果滿足下列條件,生產(chǎn)現(xiàn)場(chǎng)或臨床研究基地可以免于檢查:
1、SRA已經(jīng)核查過
2、最近核查發(fā)生在過去三年內(nèi)
3、WHO可以獲得核查信息,包括核查報(bào)告和整改報(bào)告
4、基于上述信息,WHO認(rèn)為現(xiàn)場(chǎng)符合WHO推薦的標(biāo)準(zhǔn)。
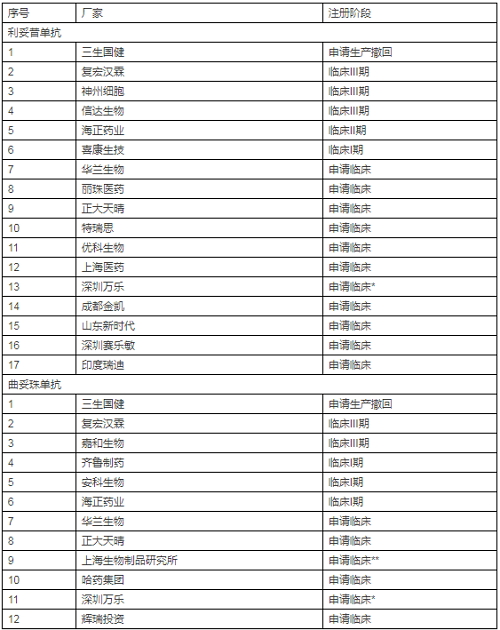
這里就體現(xiàn)了SRA批準(zhǔn)產(chǎn)品相比NRA批準(zhǔn)產(chǎn)品的優(yōu)勢(shì)了。不過目前SRA批準(zhǔn)的產(chǎn)品還不多,只有EMA批準(zhǔn)了Sandoz和Celltrion的利妥昔單抗類似物。但有一些在注冊(cè)申請(qǐng)階段,具體如下:
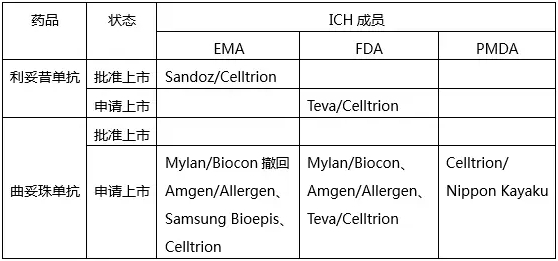
我們?cè)賮砜纯碞RA批準(zhǔn)情況。
我國尚未批準(zhǔn)利妥昔單抗或曲妥珠單抗類似物,但申請(qǐng)者卻有不少。具體見下表
*合作伙伴Celltrion;**合作伙伴mAbxience
由上表可知,兩個(gè)生物類似物產(chǎn)品扎堆申報(bào)現(xiàn)象已經(jīng)出現(xiàn)。其實(shí)原本三生國健遙遙領(lǐng)先,可惜因故撤回,令人惋惜。后起之秀中,復(fù)宏漢霖等幾家已經(jīng)占得先機(jī)(復(fù)星her2單抗生物類似物投入超2億元)。在面對(duì)國內(nèi)如此激烈的競(jìng)爭(zhēng),加之2017年7月公布新一輪醫(yī)保藥價(jià)談判結(jié)果中原研羅氏美羅華和赫賽汀分別下降45%或58%(兩個(gè)規(guī)格)和69%,留給類似物產(chǎn)品的利潤(rùn)空間大幅壓縮,為了擴(kuò)大市場(chǎng)范圍,有膽識(shí)和實(shí)力的公司是不是也在考慮走出去歷練歷練。其實(shí),國家也明確鼓勵(lì)企業(yè)到更廣闊世界去發(fā)展。
2017年7月科技部重大新藥創(chuàng)制科技重大專項(xiàng)實(shí)施管理辦公室下發(fā)《關(guān)于組織重大新藥創(chuàng)制科技重大專項(xiàng)2018年度課題申報(bào)的通知》,其中公開擇優(yōu)課題中關(guān)于國產(chǎn)藥品國際化相關(guān)研究明確指出“支持國產(chǎn)化學(xué)藥、中藥和生物藥及其制劑開展國際臨床研究,進(jìn)行臨床研究數(shù)據(jù)的評(píng)價(jià),研究制定相關(guān)技術(shù)標(biāo)準(zhǔn),突破相關(guān)關(guān)鍵技術(shù)及技術(shù)壁壘,在歐美等發(fā)達(dá)國家或“一帶一路”沿線國家注冊(cè)上市,或通過WHO預(yù)認(rèn)證。”
如此說來,國內(nèi)企業(yè)可以主動(dòng)出擊促進(jìn)CFDA與WHO開展合作,響應(yīng)科技部號(hào)召,向WHO提交生物類似物在內(nèi)的藥品預(yù)認(rèn)證申請(qǐng)。尤其是同為復(fù)星醫(yī)藥旗下復(fù)宏漢霖繼是不是也會(huì)考慮進(jìn)軍WHO市場(chǎng)呢?這樣不僅可以開拓藍(lán)海市場(chǎng),也可以在另一個(gè)國際舞臺(tái)上展現(xiàn)中國制藥人的面貌,實(shí)現(xiàn)國家和企業(yè)共同前進(jìn)。










 相關(guān)新聞
相關(guān)新聞