基因治療是將遺傳物質轉移到患者的細胞中以達到治療效果。治療性DNA大部分是使用基于腺病毒(Ad),腺相關病毒(AAV)和慢病毒(LV)等病毒載體系統(tǒng)進行遞送。隨著這些病毒載體作為臨床治療劑應用的增加,可擴展的商業(yè)化工藝(尤其是純化)正在被研究和優(yōu)化,以最大程度地確保關鍵質量屬性(CQA)的保留。本文綜述了病毒載體純化技術及不同載體種類的不同特性對選擇最佳單元操作的影響。
病毒載體的種類
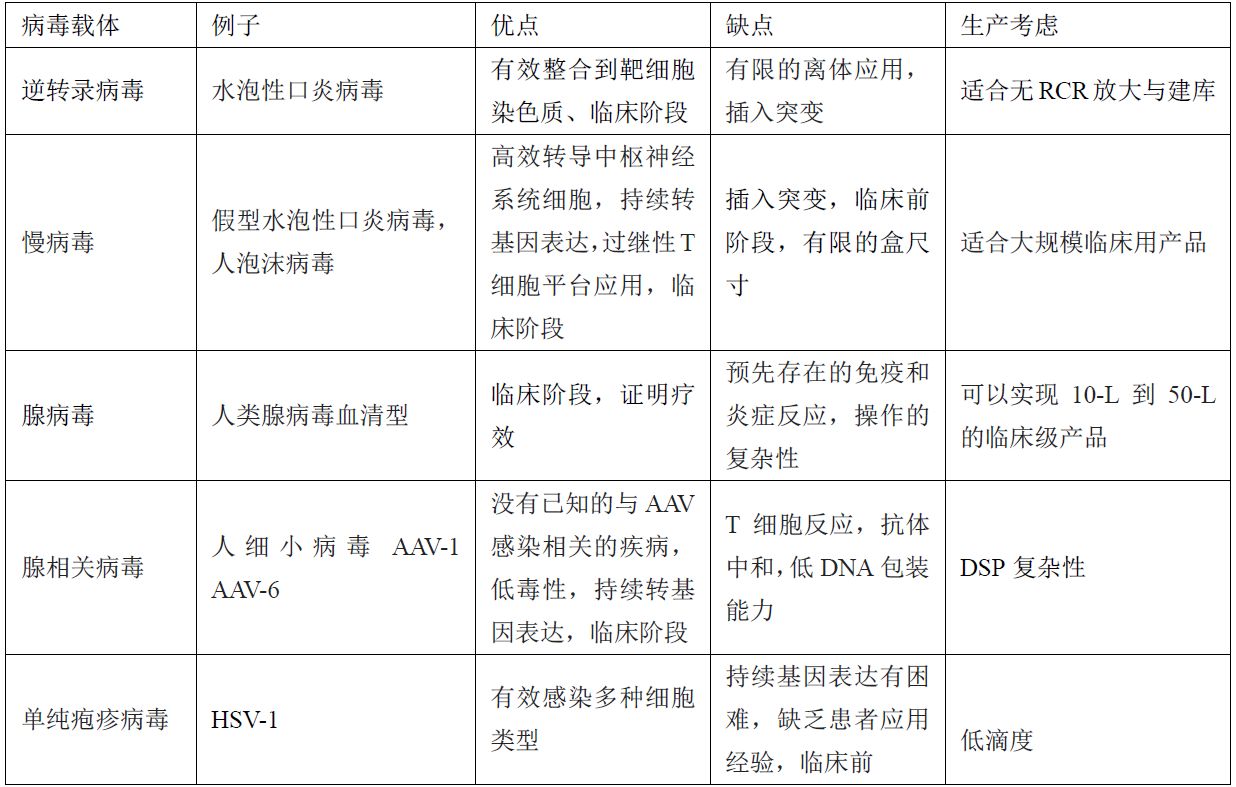
每類病毒載體對基因治療中都有自己的挑戰(zhàn)與機會(表1)。腺病毒最初用于基因治療是在20年前,但它們現(xiàn)在很少在臨床應用(它們現(xiàn)在臨床應用并不受歡迎),因為它們太復雜,比如具有挑戰(zhàn)性的載體設計和系統(tǒng)管理,龐大的基因組,以及(最重要的)高免疫原性(1)。
慢病毒已經在臨床試驗中顯示出應用前景,它們已經用于治療Wiskott-Aldrich綜合征,X連鎖腎上腺腦白質營養(yǎng)不良和異染性腦白質營養(yǎng)不良(2–4)。慢病毒重要的作用機制(MoA)是它們能轉導分裂和不分裂細胞的能力,從而產生持續(xù)的轉基因表達和潛在的治療效果。
AAV也被認為是一種有前景的基因治療工具,因為它們沒有致病性和免疫原性,同時具有持續(xù)轉基因表達和適用于各種細胞的特點[5]。目前,西方國家唯一商業(yè)化的基因治療是來自uniQure的Glybera(alipogene tiparvovec),其基于AAV1并已被用于治療遺傳性脂蛋白脂肪酶缺乏癥(LPLD)。
表1.病毒載體綜述
* AAV =腺相關病毒,HSV =單純皰疹病毒,RCR =有復制能力的逆轉錄病毒,CNS =中樞神經系統(tǒng)(包括神經元和神經膠質細胞),VSV =水泡性口炎病毒,HFV =人泡沫病毒,DSP =下游工藝生物制造方面的考慮
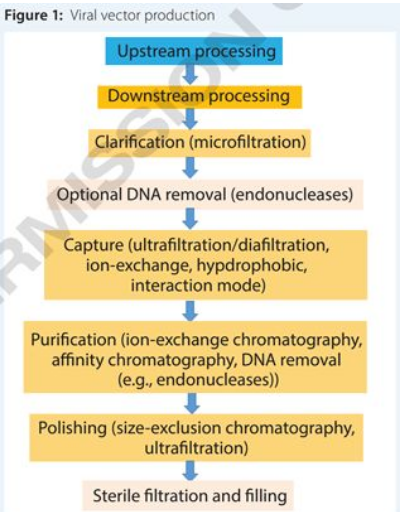
基因治療應用需要有可以生產高純度和生物活性載體的大規(guī)模生產工藝,并且能滿足化學,制造和控制(CMC)的監(jiān)管要求。它們應該是穩(wěn)定的、可擴大的、成本效益的,并且非常適用于多種病毒載體(6)。如圖1所示,病毒載體的生產由上游和下游工藝過程組成,包括幾個步驟,取決于產品的病毒特性。
用于基因治療載體的病毒顆粒的上游工藝需要病毒生長和收獲,而下游工藝側重于病毒載體的純化。值得注意的是,病毒載體的下游純化占整體制造成本的大部分,并且是病毒載體制造的瓶頸(7)。可擴展的下游工藝包含澄清(微濾),捕獲(超濾/滲濾),純化(離子交換層析(IEX)和親和層析(AF)),和精制(尺寸排阻層析(SEC)和超濾)等幾個步驟。
由于每種病毒具有不同的生物化學和物理特性,所以病毒基因治療載體的純化必須根據各自特點做相應地調整。這個過程需要進行優(yōu)化,以保持病毒感染性(與產品功效和典型的釋放測定密切相關)并最大限度得到恢復。純化方法的選擇應該考慮病毒粒子大小和穩(wěn)定性,中性pH下的電荷和相對粒子穩(wěn)定性等特征。必須徹底了解純化過程,以確定影響最終產品質量的關鍵步驟。
圖1.病毒載體制備過程病毒載體純化方法
病毒基因治療載體純化可以采取不同的方法,包括超速離心、膜過濾和柱層析法。后兩者適合于工藝放大。
超速離心主要用于實驗室規(guī)模,不能工藝放大,因為可用的轉子通常只有小容量。超速離心經常導致活性病毒顆粒的丟失,病毒聚集和剪切力是可以用來解釋的其中兩種原因(8)。與膜和柱層析相比,超速離心的自動化也是個有挑戰(zhàn)性的難題。它的使用會增加處理時間和產品降解的風險。
盡管柱色譜工具是可擴展的并且常用于生物分子純化,但它們不適合純化諸如DNA和病毒等的較大分子。在這種情況下,純化通常通過0.1μm基質擴散來實現(xiàn)。
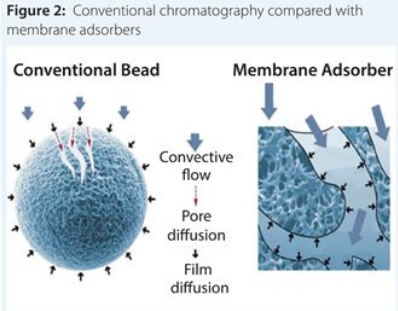
膜孔> 3μm的膜吸附器已成為流行的病毒純化工具。它們將病毒顆粒吸附到固相上。由于孔徑大,膜吸附器可以在更快的流速下工作,從而節(jié)約了的大量時間和商品成本(CoG)(9)。另一個優(yōu)勢是它們可以應用溫和的洗脫條件,這增加了保留病毒感染性的可能性(6)。圖2說明了如何利用膜吸附器實現(xiàn)病毒純化,并用珠子作為對比。
圖2:常規(guī)色譜與膜吸附的比較
純化色譜的模式
色譜法可進一步分為四種模式,分別利用不同的機制實現(xiàn)病毒的純化。IEX是基于位于病毒衣殼外部的蛋白質凈電荷。AF利用基質偶聯(lián)受體或配體與病毒衣殼之間的相互作用。SEC(凝膠過濾)根據大小將病毒從DNA,衣殼和蛋白質中分離出來。疏水作用層析(HIC)通過使用水性溶劑的疏水相互作用將病毒衣殼蛋白結合到基質上(10)。
基于載體種類的選擇模式
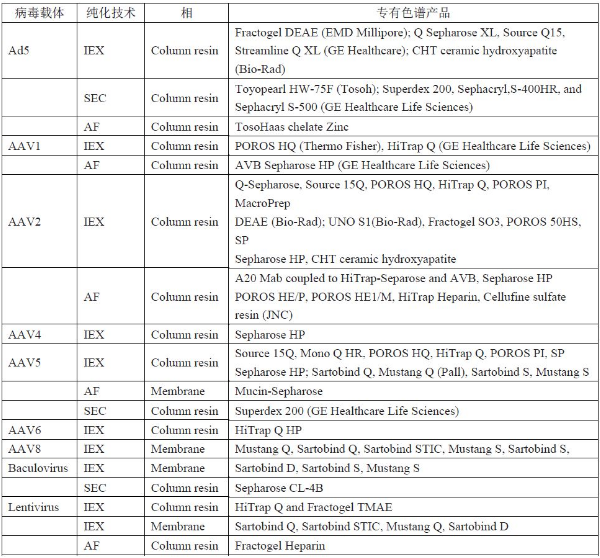
由于每種載體具有特定的特征,所以某些純化模式更易于發(fā)揮作用(表2)。為了純化腺病毒,即Ad5,可以使用上述所有的色譜方法。由于Ad病毒在中性pH下帶負電荷,因此可以使用各種陰離子交換吸附劑進行純化。
表2. 載體純化色譜產品
IEX =離子交換色譜; SEC =尺寸排阻色譜,AF =親和色譜
使用陰離子交換劑的IEX也被報道用于幾種AAV(11)。固定化金屬親和層析(IMAC)是可以純化Ad的另一種方法。該方法基于將Ad顆粒與結合到柱上的帶電鋅離子結合。該方法為純化AAV提供了幾種選擇,例如特別適用于AAV2純化的肝素親和層析(12)。SEC是適用于精制Ad和AAV5的方法,HIC可以用高濃度的硫酸銨和其他鹽(13)來純化Ad顆粒。后一種方法尚未被描述用于純化AAV血清型(10)。
由于慢病毒帶負電荷,所以純化慢病毒的常規(guī)方法是使用膜吸附器和捕獲步驟中使用的基于柱的AEX工具。這個步驟在不同的病毒載體純化組中變化最大。慢病毒也可以通過使用肝素親和層析來純化,但是它引入了一種動物來源的試劑,在大規(guī)模的基因治療生產中應該被淘汰[14]。最后,桿狀病毒通常在捕獲步驟中使用膜基陰離子交換劑,再用陰離子交換膜吸附劑和SEC來純化。有進展,但依然有許多工作要做 基因治療生物制備中的純化技術的選擇對終產品質量和CoG非常重要,而且是一個多因素的過程。雖然用于基因治療的平臺化生物工藝不斷涌現(xiàn),但它們尚未完全建立起來。
每個載體都需要進行徹底的表征和工藝開發(fā)。然而,傳統(tǒng)的大規(guī)模純化技術(特別是色譜方法)非常適合基因治療生物工藝。因此尋求將基因工程方法中的新興基礎科學專業(yè)知識與已有的生物加工技能和技術相結合,以更好的服務于這個新興行業(yè)。
我們掌握了建立可持續(xù)和可獲利的基因治療產業(yè)所需的工具和技術。但是手中的挑戰(zhàn)是如何去最佳配置它們,以加速發(fā)展挽救生命和將有效的基因治療應用到臨床,而且還要有可以通過監(jiān)管部門的數(shù)據和能夠承擔的成本。








 相關新聞
相關新聞