
緊跟新藥前沿,專注研發(fā)創(chuàng)新
獲批
美國快速批準(zhǔn)抗瘧藥氯喹等治療冠狀病毒
當(dāng)?shù)貢r間3月29日,美國食品和藥物管理局(FDA)發(fā)布了一項關(guān)于羥氯喹(hydroxychloroquine)和氯喹(chloroquine)的緊急使用授權(quán)令(EUA)。盡管證據(jù)不足,這兩種已有數(shù)十年歷史的抗瘧藥物在特朗普的大力倡導(dǎo)下正在美國用于治療新冠病毒。
FDA允許藥物在臨床試驗尚不可用或可行時,在合適的情況下,由醫(yī)生分配和指定給住院青少年和成人患者。該授權(quán)僅適用于目前住院且體重至少為50公斤(約110磅)的患者。根據(jù)緊急使用授權(quán),提供者必須聯(lián)系當(dāng)?shù)鼗蛑菪l(wèi)生部門以獲得藥物。雖然關(guān)于氯喹或羥基氯喹療效的證據(jù)有限,但FDA表示,這些藥物的益處大于風(fēng)險。不過,F(xiàn)DA鼓勵進(jìn)行隨機(jī)臨床試驗,以評估這些藥物的有效性。
國內(nèi)首張異體CAR-T臨床批件獲批
4月2日,亙喜生物科技(上海)有限公司(簡稱:亙喜生物)的GC007注射液(受理號:CXSL1900151)按照1類新藥成功申報臨床批件,適應(yīng)癥針對于異基因移植后復(fù)發(fā)難治性CD19陽性急性B淋巴細(xì)胞白血病,成為國內(nèi)第一家獲得臨床批件的異體CAR-T產(chǎn)品。

嵌合抗原受體 (CAR-) T 細(xì)胞是經(jīng)過基因工程改造的 T 細(xì)胞,重新靶向腫瘤表面抗原,結(jié)合并殺死腫瘤細(xì)胞。這些 T 細(xì)胞提取自患者自己(自體)或健康供體(同種異體)的血液,經(jīng)過激活、修飾、和擴(kuò)增后輸注到患者體內(nèi)。常規(guī) CAR-T 細(xì)胞的制備需要數(shù)周的時間,制造成本高昂。對于預(yù)期壽命非常有限的晚期患者,過長的生產(chǎn)時間會讓治療效果遠(yuǎn)低于預(yù)期。
合作
開發(fā)雙重靶向CAR-T療法,Kite達(dá)成合作
4月3日,吉利德科學(xué)(Gilead Sciences)旗下Kite公司和Teneobio公司聯(lián)合宣布,雙方已達(dá)成一項許可和合作協(xié)議。他們將利用Teneobio專有的人源重鏈抗體(UniAb)平臺開發(fā)新一代具有雙重靶向的CAR-T療法,治療多發(fā)性骨髓瘤(MM)患者。

不同于由兩條重鏈和兩條輕鏈組成的普通抗體,Teneobio公司專有的人源化重鏈抗體僅由重鏈組成,因此體積相對更小。使用這種較小的抗體片段,可以將表達(dá)多個嵌合抗原受體(CAR)轉(zhuǎn)基因嵌入病毒載體中,進(jìn)而達(dá)到更好地改造T細(xì)胞,提高攻擊腫瘤效力的目的。
Windtree Therapeutics和李氏大藥廠達(dá)成研發(fā)資助合作協(xié)議
2020年3月31日,生物技術(shù)和醫(yī)療器械公司W(wǎng)indtree Therapeutics,Inc.(OTCQB:WINT)致力于開發(fā)候選藥物和醫(yī)療器械技術(shù)以解決急性心血管疾病和肺部疾病,該公司宣布與香港李氏大藥廠(Lee's)已達(dá)成具有約束力的條款單(TS)合作,據(jù)此,李氏大藥廠將為公司的主要急性肺部候選藥物AEROSURF?的持續(xù)開發(fā)提供項目資金,用于治療早產(chǎn)兒的呼吸窘迫綜合征(RDS)。這筆資金將資助AEROSURF臨床2b期橋接研究,如果成功,其目的是將產(chǎn)品過渡到3期臨床產(chǎn)品開發(fā)階段。
融資
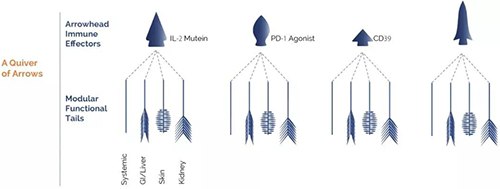
B輪融資8000萬美元,它的“免疫療法之箭”為何獲得青睞
4月2日,Pandion Therapeutics公司宣布完成8000萬美元B輪融資,以支持其治療自身免疫性疾病的模塊化蛋白(modular proteins)和雙特異性抗體的開發(fā),其中包括治療潰瘍性結(jié)腸炎的PT101。該公司曾上榜2018年“生物技術(shù)猛公司”榜單,并與安斯泰來(Astellas Pharma),Twist Bioscience公司達(dá)成合作。
圖片來源:PandionTherapeutics官網(wǎng)
該公司專有的模塊化平臺(modular approach)可以將免疫調(diào)節(jié)劑與靶向特定組織的連接子相結(jié)合,形成在精確位置產(chǎn)生治療作用的模塊化蛋白質(zhì),抗體和雙特異性抗體。這種方法能夠?qū)⒚庖哒{(diào)節(jié)功能精確控制在全身或局部組織,將治療效果最大化的同時避免了免疫調(diào)節(jié)藥物的副作用,達(dá)到恢復(fù)免疫穩(wěn)態(tài)的目的。
急性腎損傷公司完成5200萬美元融資,加速新藥上市
2020年3月31日,臨床制藥公司AM-Pharma BV(以下簡稱“ AM-Pharma”)憑借其創(chuàng)新領(lǐng)先的重組人堿性磷酸酶治療劑(recAP)用于急性腎損傷(AKI)治療,宣布已籌集了4700萬歐元(5200萬美元)的額外資金,使最近的融資總額增加到1.63億歐元(1.76億美元)。

這項新資金將用于支持多國關(guān)鍵性的recAPⅢ期臨床試驗,該試驗對1400名膿毒癥相關(guān)急性腎損傷(SA-AKI)患者進(jìn)行治療。它還使公司能夠為完成試驗后提交營銷授權(quán)申請所需的步驟提供資金,包括CMC驗證和商業(yè)制造。
關(guān)于美迪西
美迪西(股票代碼:688202)是一家藥物研發(fā)外包服務(wù)公司(CRO)。成立于2004年2月2日,公司走過16個年頭,在上海建立了一家集化合物合成、化合物活性篩選、結(jié)構(gòu)生物學(xué)、藥效學(xué)評價、藥代動力學(xué)評價、毒理學(xué)評價、制劑研究和新藥注冊為一體的符合國際標(biāo)準(zhǔn)的綜合技術(shù)服務(wù)平臺,并得到了國際藥品管理部門的認(rèn)可。美迪西普亞的動物實驗設(shè)施獲得AAALAC(國際動物評估與認(rèn)證協(xié)會)認(rèn)證和國家藥品監(jiān)督管理局NMPA GLP證書,并已達(dá)到美國食品藥品管理局GLP標(biāo)準(zhǔn)。
美迪西擁有豐富的全球合作經(jīng)驗,2015年以來,美迪西在全球服務(wù)超過500家活躍客戶,已為武田制藥、強(qiáng)生制藥、葛蘭素史克、羅氏制藥等多家全球性制藥公司及恒瑞醫(yī)藥、揚子江藥業(yè)、石藥集團(tuán)、華海藥業(yè)、眾生藥業(yè)等國內(nèi)外知名客戶提供研發(fā)外包服務(wù)。
聯(lián)系我們
Email: marketing@medicilon.com.cn
電話: +86 (21) 5859-1500(總機(jī))













 相關(guān)新聞
相關(guān)新聞