



業務咨詢
中國:
Email: marketing@medicilon.com.cn
業務咨詢專線:400-780-8018
(僅限服務咨詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




11月29日,美迪西臨床前毒理研究部副總裁曾憲成博士在基因治療系列公開課【第4期】中做了主題為《對基因治療產品非臨床研究策略的思考》的報告,本文根據專家報告內容整理,并經專家審核確認。
曾憲成博士,美迪西臨床前毒理研究部副總裁
高級工程師,2010年在上海醫藥工業研究院獲得醫學博士學位,2010-2013年在國家上海新藥安全評價研究中心工作,在此期間被派往國家食品藥品監督管理總局藥品審評中心進行新藥審評理論和技術培訓和實踐;2013年加入美迪西普亞醫藥科技(上海)有限公司,現任毒理研究部副總裁,從事生物技術藥物、疫苗及化學藥品一般毒性試驗研究并承擔毒理研究部團隊管理工作。作為項目負責人完成了20個1類化藥、8個抗體偶聯藥物、10個單克隆抗體、2個激素藥物、2個預防用疫苗及1個復方藥物申報中國和/或美國整套的一般毒性和藥代動力學研究。作為課題負責人承擔了上海市科委資助的實驗動物專項研究2項,作為子課題負責人參與了“十一五”國家新藥創制重大專項研究。
若按照藥物結構分類,部分GT產品其實也屬于核酸藥物,比如使用非病毒載體遞送的GT產品。核酸藥物由于它本身獨特的物理化學和藥理學特點,屬于新的臨床治療藥物種類,為人類提供了藥物研究的新領域。
小分子藥物,蛋白藥物或抗體藥物是當前主要的臨床治療藥物類型,靶點主要是蛋白質,比如酶類,受體,離子通道,轉運體和激酶等。但尋找一個新的靶點,并開發成藥物仍然是困難重重。
在罕見病領域,常規藥物難以發揮作用,但或許可以依賴GT產品解決。核酸藥物目前主要的應用領域是在單基因干擾,而且比較多的罕見病屬于單基因異常,NIH報告目前有7000種罕見病,其中約80%是單基因異常,半數病例為兒童,而95%尚無治療手段;對于多基因異常的疾病,核酸藥物是不是能發揮一定的作用尚待研究。
當前核酸藥物治療分為三個主要方向:補充基因突變失去的功能(如導入正常基因的療法);抑制或沉默異常基因(如RNA干擾療法);直接糾正異常基因結構(如基因編輯療法)。
基因治療產品一般通過將外源基因(或基因編輯工具)導入靶細胞或組織,替代、補償、阻斷、修正、增加或敲除特定基因以發揮治療作用。按照基因導入人體的方式不同,基因治療可分為體內(in vivo)基因導入和體外(ex vivo)基因導入兩種方式。
體內基因治療產品將外源基因(或基因編輯工具)通過適當的載體直接導入人體發揮治療作用,而體外基因治療產品一般在體外將外源基因(或基因編輯工具)導入細胞,制備成為經基因修飾的細胞或細胞衍生產品,最終經回輸以發揮治療作用。(NMPA,《體內基因治療產品藥學研究與評價技術指導原則》(試行),2022.05)
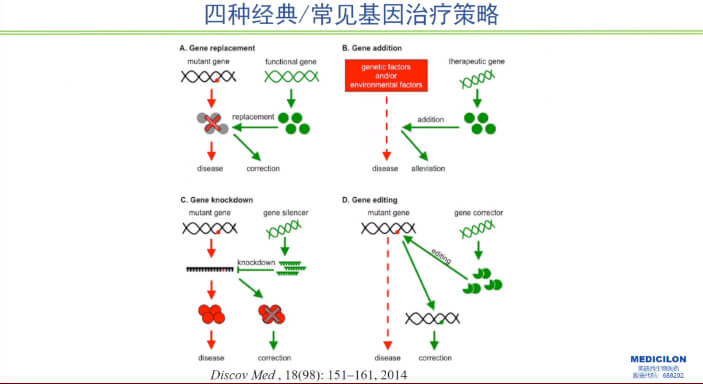
圖1 四種經典/常見基因治療策略
對GT產品來講,遞送系統是它研究的一個重要方面,到目前為止還沒有一個非常理想的遞送系統。目前GT產品常用的遞送系統可以分為病毒和非病毒載體系統。病毒載體系統目前用的比較多的有逆轉錄病毒,慢病毒,腺病毒(免疫原性較強)和腺相關病毒等。非病毒載體主要有脂質納米粒等。
病毒和非病毒載體進入細胞方式、特點及其后續命運決定了組織分布必會成為這類藥物研究的重點。另外一方面,應該選擇什么動物種屬?兩種載體進入細胞的方式,轉基因從內吞小體的釋放,入細胞核方式,后續的轉錄及翻譯過程等都是試驗動物種屬相關性考慮的重點。另外還要考慮相關種屬解剖結構(比如大腦和脊髓解剖結構、組織尺寸大小及功能方面;大動物,如猴和豬,比大鼠更接近人,尤其是病毒載體,因為病毒傳播一個重要途徑是通過神經。)
相關動物種屬的選擇還應該考慮以下方面:藥效靶器官被有效轉導;載體安全性已知;轉基因表達水平與人體可比性;該種屬動物可以呈現該疾病狀態;動物對基因修飾細胞及轉基因表達產物的生物學反應與預期的人體反應的相似性;動物對異種來源的基因修飾細胞的免疫耐受性;動物病理生理學特征與擬用患者人群的相似性;臨床擬用遞送/給藥方式的可行性。
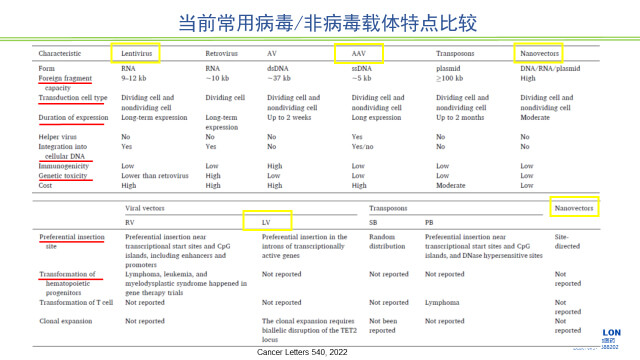
圖2 當前常用病毒/非病毒載體特點比較
正因為病毒載體,尤其是逆轉錄,有整合到基因組的風險,所以使用病毒載體,尤其是逆轉錄病毒載體的GT產品通常要評估致癌性。所以對于基因修飾細胞產品來說,致癌性的評估在指導原則中又被放到非常醒目的位置。
2021年《基因治療產品非臨床研究與評價技術指導原則(試行)》中對致癌性的評估要求有以下幾點:標準的嚙齒類動物致癌性試驗一般不適于評價基因治療產品。可采用證據權重(Weight of Evident, WoE)方法來評估致癌風險,必要時進行致癌性研究。WoE關注因素一般包括但不限于:藥物靶點和藥理作用通路與致癌性相關(例如導入基因產物是生長因子);靶點和信號通路的藥理作用特征預測與腫瘤發生發展有一定相關性。插入突變研究的相關結果提示有致癌風險。載體設計中有潛在致癌風險;生產體系中存在引入致癌成分。一般毒理學試驗組織病理學發現,包括彌漫性和/或局灶性細胞增生、持續的組織損傷和/或慢性炎癥,癌前病變和腫瘤發生;激素紊亂。免疫抑制等。目前對基因修飾的細胞產品,除要進行上述致癌性評估外,還需要進行成瘤性評價。
以病毒為載體的基因治療產品在體內的發生過程如圖3。AAV的細胞表面黏附由初級糖鏈受體介導,并由蛋白質類次級受體穩定。然后以AAV為基礎的載體在通往細胞核的過程中利用多種內吞途徑。隨后RAAV衣殼在分選室(內小體和高爾基體)中經歷了實質性的構象變化。在逃離分選室后,載體粒子聚集在核周空間,并通過核孔復合體進入細胞核。在細胞核內,載體基因組被釋放和轉錄,實現轉基因的表達。
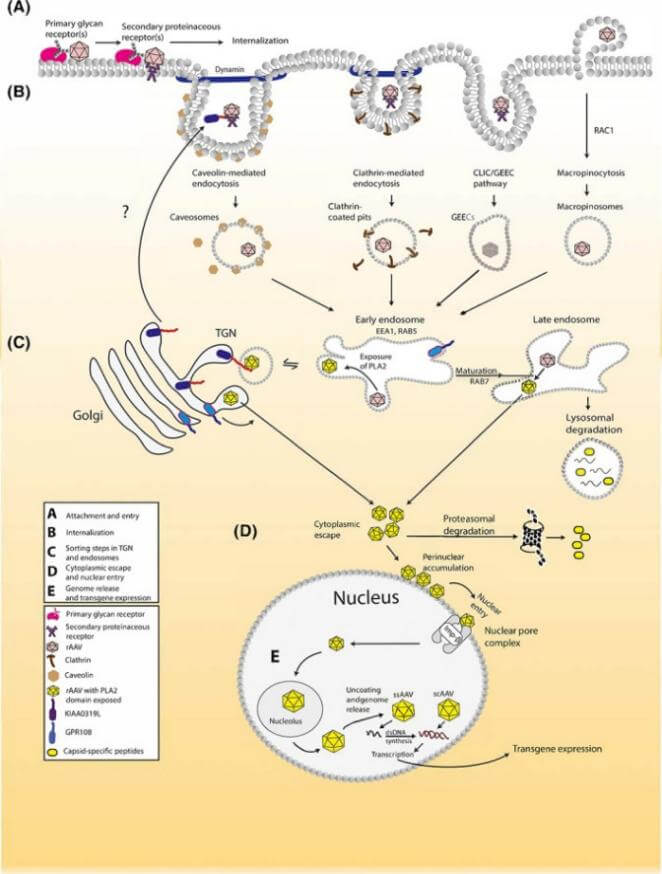
圖3 以AAV病毒載體為例
經典的基因治療產品體內過程
如圖4顯示的是GT產品進行非臨床評價項目一般策略。藥理學研究方面需要做動物模型有效性研究,概念驗證及安全藥理;藥代動力學的研究則要重點研究暴露量,生物分布及脫落研究;毒理學方面要做一般毒理學,免疫原性,免疫毒性,遺傳生殖毒性,致癌性,局部耐受性和病毒脫落風險(尤其是復制型病毒)研究。

圖4 基因治療產品要進行的非臨床評價項目
除此之外,2017年歐盟、美國、日本等三個政府或經濟聯合體在Yale Journal of Biology and Medicine上發表文章推薦基因治療產品非臨床安全研究要關注以下問題:制劑組分引起的毒性(比如脂質體不同組分及其它污染物,輕則產生免疫原性重則會致癌),給藥途徑引起的毒性(局部用藥還是系統用藥),非靶細胞/組織異常分布(脫靶問題),載體及轉基因持續表達及其表達水平(直接決定了實驗動物數據的價值),非靶細胞/組織病毒復制水平,免疫激活和抑制,針對載體的免疫反應,靶細胞活化狀態/表型,潛在的插入突變/致癌,潛在的生殖器官傳播,潛在的由患者向家庭成員及照料者的水平傳播(如脫落)等。
GT產品的病毒/非病毒載體遞送的是核酸。在機體漫長的進化過程中衍生了一系列識別外來物質的系統或通路,如模式識別受體。當核酸被模式識別受體識別后先會引起先天性免疫反應,這也正是我們要關注的基因治療產品給藥之后引起的早期/急性毒性反應。無論病毒還是非病毒載體,由于遞送內容化學結構非常相似,會共用相同識別系統,最后產生相似的生物學效應,如產生I型干擾素,II型干擾素,細胞因子等。同時為后期激活適應性免疫做鋪墊。后期產生的適應性免疫主要分為細胞免疫和體液免疫,體液免疫是針對病毒的衣殼,或病毒衣殼被降解之后的產物,或轉基因表達產物等外來物質產生相應的抗體。如果是細胞治療產品,本身就會引起細胞免疫反應。病毒載體免疫原性來源分析如圖5。

圖5 病毒載體免疫原性來源分析
在做非臨床毒性研究時要重點關注先天性免疫和適應性免疫反應,常用ELISA,qPCR,ELISpot等方法監測,有時候需要對產生的抗體進行中和抗體屬性鑒定時候會采用一些干擾活性潛能研究的方法。
當我們獲悉了免疫原性來源之后將會增加對指導原則相應條款及要求的理解。指導原則中提到:基因治療產品可能導致的免疫反應包括先天性免疫和適應性免疫反應。多種因素可顯著影響基因治療產品的先天性和適應性免疫反應,如宿主因素(前期接觸過相關病毒血清型和/或導入基因產物,免疫系統狀態)、基因遞送方式(遞送系統種類、給藥途徑和靶組織)、載體(載體種類、血清型、劑量和導入基因的調控原件類型等)、導入基因的產物、異位表達基因產物(特別是針對免疫豁免器官和/或部位特異性表達的基因產物)。基因治療產品的免疫原性可能來源于產品中的非人源化組分、導入基因的表達產物、載體、基因編輯產生的非預期的肽/蛋白質等。病毒載體類基因治療產品相對更容易產生免疫原性。此外,還應考慮實驗動物預存免疫對試驗的影響。
既然免疫原性不可避免,可以做一些消除免疫原性影響的工作。常見策略是使用藥物干預而實現免疫抑制。目前研究文獻中也有提到其他方式,如通過控制劑量并利用肝臟獨特的不活躍的免疫環境,或利用AAV-CAR Tregs來控制病毒載體的免疫原性。(Frontiers Immunology,2020:11;Molecular Therapy: Methods & Clinical Development,2021:23)。除上述提到的控制免疫原性的策略之外,還有諸多其他不同的方式。這主要是提醒我們,要關注到預存抗體對實驗結果的影響,如果研究這類產品,沒有做預存抗體篩選,注定實驗結果多數情況下會失敗或無申報價值。
病毒載體組織分布及排出/脫落(shedding)研究重點要關注大腦,兩大傳播途徑,即血液和神經等;除此之外還要關注在生殖系統有沒有分布。了解上述內容之后,關于指導原則對生物分布(含排出/脫落)研究的規定就更容易理解了。在生殖毒性研究方面,基因治療產品應根據受試者的產品類型、作用機制、一般毒理發現、生物分布特征以及患者人群來評估潛在的生殖/發育毒性風險。如果基因治療產品擬用于有生育可能或妊娠人群,應研究產品對胎兒的影響(例如細胞因子局部生成后通過胎盤轉運),開展胚胎-胎仔發育和圍產期毒性試驗。如果在一般毒理學試驗中發現有潛在的生殖器官毒性反應,應開展生育力和早期胚胎發育毒性試驗。當基因治療產品在生殖器官持續存在時,需要進一步確定其在生殖細胞(例如卵母細胞、精子)的暴露水平。
當前GT治療產品在以下幾個方面存在挑戰:
1. 在實驗研究設計/安排方面,長周期的毒性研究(如6個月毒性試驗)是否總是需要;選擇毒性試驗劑量的最好方法;若有免疫原性,進行毒性研究的最好方式;生物分布研究需要采集多少組織;如果采用相同的病毒衣殼及增強子或相同的脂質納米粒遞送系統,但轉基因不同,是否仍需要進行生物分布研究;如果已有文獻數據證明低風險,對于低/不整合的載體是否仍有必要進行整合性研究;
2. 研究數據分析方面,動物體生物分布/表達/不良反應如何外推至人;歷史數據缺乏;
3. 不同方法間、同一家公司不同場所間、公司和外包生產商間、外包生產商批次間等產品間質量一致性方面,什么樣的體外比對研究已經可以充分說明可比性;多大的產品不同會導致額外毒性研究;何時及需要哪些研究以研究清楚差異的影響;
4. 后期開發方面,需要哪些研究以支持有妊娠需求婦女用藥;
5. 監管方面,某些方面在不同監管機構間尚未達成一致;晚期開發如何進行缺乏清晰的指導原則(如生殖發育毒性試驗及致癌性試驗策略)(Molecular Therapy: Methods & Clinical Development,2020 )。
12月20日20:00-21:30
基因治療公開課(第5期)將開始直播
歡迎觀看
