仿制藥制劑出口在當(dāng)下已成為國內(nèi)藥企的重要意識,越來越多的制藥企業(yè)開始將業(yè)務(wù)拓展到海外。一方面海外業(yè)務(wù)為國內(nèi)藥企帶來可觀收入,另一方面被美國或歐盟批準的制劑產(chǎn)品使藥企拿到綠色通行證,獲得更快的國內(nèi)報批資格。那么制劑出口需要建立怎樣的體系?研發(fā)及生產(chǎn)流程是怎樣的模式?
以美國市場為例,仿制藥制劑產(chǎn)品需要在FDA(美國藥監(jiān)局)認證的cGMP(動態(tài)藥品生產(chǎn)管理規(guī)范)條件下生產(chǎn),并具有與原研產(chǎn)品較高的體內(nèi)外一致性,才有資格獲批進入美國市場銷售。也就是說,首先,藥企需要擁有一個FDA認證過的cGMP車間;其次是關(guān)注產(chǎn)品質(zhì)量,開展體內(nèi)外一致性評價研究;最終目標是獲得與原研產(chǎn)品體內(nèi)生物利用度一致的仿制藥產(chǎn)品,也就是我們常說的通過BE(生物等效性)實驗。
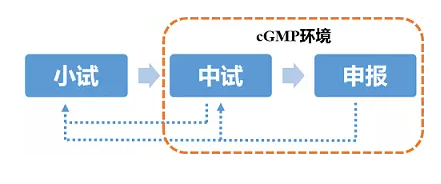
產(chǎn)品的研發(fā)從實驗室小試,到車間中試放大,再到申報生產(chǎn),是一個較為漫長且需經(jīng)過不斷反復(fù)循環(huán)的過程,通常經(jīng)歷3-5年時間。
實驗室小試階段
批量通常在200g~2kg
當(dāng)仿制藥產(chǎn)品立項后,需要對原研產(chǎn)品進行較為全面的調(diào)研及檢測工作。其目的在于明確研發(fā)目標,使研發(fā)的每一個環(huán)節(jié)的目標具體化、量化及可控化。
調(diào)研工作包括:原研產(chǎn)品的新藥保護期信息、FDA橙皮書中收錄的關(guān)于該產(chǎn)品的專利保護內(nèi)容、原研產(chǎn)品的制劑組成、相關(guān)專利提供的可能的制劑制備方法、以及FDA推薦的溶出方法和BE實驗方案等;
檢測工作包括:原研產(chǎn)品的外觀尺寸、藥物含量、雜質(zhì)及藥物溶出曲線等測定數(shù)據(jù)。
對原研產(chǎn)品的處方及工藝越了解,則越有利于仿制藥的研發(fā)。然而,F(xiàn)DA明確披露的只有處方中的輔料類別,即產(chǎn)品由原料藥與哪些輔料組合而成。而對于每種輔料所占的確切比例,以及制劑的實際制備工藝并無介紹,通常需要通過一些相關(guān)專利或文獻的信息披露推測獲得,這也是仿制藥產(chǎn)品要摸索的最關(guān)鍵的環(huán)節(jié)之一。如果專利中明確保護了某種輔料或某個工藝,那么在專利過期前需要規(guī)避并選擇其他解決方案,這就使仿制藥的制劑研發(fā)難度大大提高。
對原研產(chǎn)品理化性質(zhì)的測定幫助我們更好的理解目標性狀。對于口服固體制劑來說,通常在溶出實驗中具備與原研片一致性較高的產(chǎn)品才有更高的BE實驗通過率。因此在這一階段,我們最關(guān)注的是所研發(fā)仿制藥的溶出曲線與原研產(chǎn)品的匹配情況,而如何開發(fā)體內(nèi)外相關(guān)性高的溶出方法,更是BE實驗獲勝的關(guān)鍵。
在實驗室小試階段,通過對處方及工藝的篩選及優(yōu)化,獲得與原研產(chǎn)品溶出度非常接近的產(chǎn)品,并明確處方中的關(guān)鍵輔料及工藝中的關(guān)鍵參數(shù)對溶出曲線的影響趨勢。值得注意的是,搞清楚影響趨勢,要比“碰運氣”找到了最佳溶出曲線重要得多。
中試放大階段
批量通常在20kg~50kg
優(yōu)化獲得了與原研產(chǎn)品較為接近的備選處方后,即可進入車間中試放大階段。通常從這一階段開始到未來申報生產(chǎn)及商業(yè)化生產(chǎn)等均要求在cGMP環(huán)境下操作。
從小試到中試,是批量變化最大的一步,也是最容易產(chǎn)生“放大效應(yīng)”的一步,處理好放大效應(yīng)是產(chǎn)品最終走向申報乃至商業(yè)化生產(chǎn)的成功關(guān)鍵。
放大效應(yīng)有兩個方面:一是參數(shù)的設(shè)計問題,即如何參照小試的設(shè)備工藝參數(shù)來設(shè)定中試放大中大設(shè)備的工藝參數(shù)。打個比方說,煮1個雞蛋如果需要10分鐘,那么煮20個雞蛋通常不只是相同的10分鐘,也一定不需要等比擴大20倍后的200分鐘。因此,推算并確定中試放大的關(guān)鍵工藝參數(shù)是一個難度較大的問題。
另一個容易出現(xiàn)的放大效應(yīng)是,有些問題在小試實驗中不存在或很小,到中試生產(chǎn)才顯現(xiàn)出來并存在嚴重缺陷,也就是放大生產(chǎn)可行性的問題。例如,一些產(chǎn)品在實驗室小試中并無壓片問題,但在中試生產(chǎn)高速旋轉(zhuǎn)壓片時可能出現(xiàn)物料粘沖、分層、可壓性差的問題,這些問題只有在批量較大時才會顯現(xiàn),因此即使小試研發(fā)的產(chǎn)品質(zhì)量再好,在未來也是無法量化生產(chǎn)的。
在解決了上述“放大效應(yīng)”問題后,我們來關(guān)注產(chǎn)品質(zhì)量。大部分產(chǎn)品在研發(fā)時,相同的處方及工藝在小試和中試放大分別得到的產(chǎn)品的溶出曲線存在一定差異,通常會返回實驗室進行調(diào)查研究,以及重復(fù)放大生產(chǎn)進一步優(yōu)化參數(shù)設(shè)計。當(dāng)然,如果在小試研發(fā)階段對溶出曲線變化趨勢的影響因素研究的十分清晰透徹,也可更快更準確地使產(chǎn)品接近目標值。
這樣的交叉循環(huán)反復(fù)工作可能持續(xù)半年到兩年的時間,甚至更久,視產(chǎn)品研發(fā)難度及放大效應(yīng)大小而定,最終目標是獲得與原研產(chǎn)品體外各方面指標一致且質(zhì)量可控的中試產(chǎn)品。
申報生產(chǎn)階段
批量通常在50kg~150kg
申報生產(chǎn)是整個研發(fā)過程中最為關(guān)鍵的一個環(huán)節(jié),也是申報材料中FDA最關(guān)注的生產(chǎn)批次。目前FDA的要求是,須連續(xù)生產(chǎn)三批且每批批量不小于10萬片(粒)的產(chǎn)品。這里的連續(xù),并非中間一天不能停歇,而是中間不能再穿插任何放大生產(chǎn)批次。
由于申報批的批量與中試批量相差不多,為了節(jié)省時間及成本可視研發(fā)難度等情況考慮是否在申報批前做1-2批與申報批次同等批量的放大研究。
三批申報產(chǎn)品生產(chǎn)完成后,需要同時開展長達6個月的加速穩(wěn)定性實驗和長達3年的長期穩(wěn)定性實驗,只選擇其中一批進行BE實驗(通常是第一批),并撰寫及整理申報材料。6個月加速穩(wěn)定性實驗結(jié)束后,如果檢測結(jié)果符合標準,且已通過BE實驗,則這三批申報產(chǎn)品具備申報資格,可以向FDA遞送材料進行申報。材料遞送后,F(xiàn)DA還需要1-2年審批時間,中間會提出一些缺陷性問題,藥企需回答問題,并可能還需要補充小試或中試實驗數(shù)據(jù),同時補充不斷獲得的長期穩(wěn)定性實驗數(shù)據(jù)。
在申報生產(chǎn)環(huán)節(jié),最為關(guān)鍵同時也是難度最大的一個步驟是BE實驗。只有BE實驗成功的申報批產(chǎn)品,才意味著在體內(nèi)的釋放及吸收行為與原研產(chǎn)品完全一致。美國市場仿制藥BE實驗的成功率僅為48%左右。一旦BE失敗,三批申報產(chǎn)品全部報廢,研究者要對失敗原因進行全面的調(diào)查和評估。
通常情況下,如果BE實驗結(jié)果與原研產(chǎn)品相差甚微時,有以下兩種途徑快速重新完成申報工作。①如果僅僅是在生產(chǎn)過程中工藝參數(shù)控制不當(dāng),可在設(shè)置范圍內(nèi)做細微調(diào)整,并立即重新開始三批申報工作;②如果需要調(diào)整的工藝參數(shù)超出生產(chǎn)文件設(shè)置范圍,則需要修改升級生產(chǎn)文件后,再進行申報生產(chǎn)。
如果BE實驗結(jié)果與原研產(chǎn)品相差較大時,很可能就要返回到最初的實驗室小試階段重新開始研究。
可能有人會問,體外溶出實驗中申報產(chǎn)品已與原研產(chǎn)品具有較高的溶出匹配度,為什么體內(nèi)BE實驗還會失敗?一般來說,未找到更具區(qū)分性或與體內(nèi)相關(guān)性更好的溶出方法是BE失敗的主要原因。因此實驗室小試研究需要這可能是因為缺乏深入全面的體外溶出實驗研究。著重確定最佳的溶出分析方法,并在新方法下重新優(yōu)化處方及工藝。
結(jié)語
制劑出口海外市場前景廣闊,但對制劑質(zhì)量的要求也極高,所需研發(fā)周期較長,成本較高,因此對于藥企來說,需要具備豐富的制劑技術(shù)經(jīng)驗與資本積累,才有可能生存下去。這也極大推動了中國藥企制劑水平的飛速發(fā)展,使市場建立起優(yōu)勝劣汰的健康的競爭模式。









 相關(guān)新聞
相關(guān)新聞