



業(yè)務(wù)咨詢
中國(guó):
Email: marketing@medicilon.com.cn
業(yè)務(wù)咨詢專線:400-780-8018
(僅限服務(wù)咨詢,其他事宜請(qǐng)撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




近日,《仿制藥質(zhì)量和療效一致性評(píng)價(jià)臨床有效性試驗(yàn)一般考慮(征求意見稿)》掛網(wǎng),而此前,為推進(jìn)一致性評(píng)價(jià)工作,CFDA已數(shù)次發(fā)出相關(guān)文件含各大征求意見稿。我們看到,工作的推進(jìn)需要各方面統(tǒng)籌協(xié)調(diào),完善工作機(jī)制,研究解決開展過(guò)程中遇到的各種難題,特別是選擇參比制劑、臨床試驗(yàn)資源緊缺等問(wèn)題,都是需要解決的。
為加快制藥企業(yè)開展該項(xiàng)工作的進(jìn)度,幫助企業(yè)解決實(shí)際難題,CFDA今年以來(lái)已在各地舉辦了數(shù)場(chǎng)培訓(xùn)。上月中旬,主管部門相關(guān)負(fù)責(zé)人在某重要論壇做了“藥品監(jiān)管創(chuàng)新與醫(yī)藥行業(yè)供給側(cè)結(jié)構(gòu)性改革”的主題報(bào)告,梳理了仿制藥一致性評(píng)價(jià)相關(guān)政策,并指出:“仿制藥質(zhì)量和療效一致性評(píng)價(jià)工作正轉(zhuǎn)入全面評(píng)價(jià)階段。”同時(shí)重申了開展仿制藥一致性評(píng)價(jià)的目標(biāo):提升制藥行業(yè)整體水平,保證公眾用藥安全有效;推動(dòng)制藥行業(yè)供給側(cè)改革,促進(jìn)產(chǎn)業(yè)結(jié)構(gòu)調(diào)整;增強(qiáng)國(guó)際競(jìng)爭(zhēng)力,促進(jìn)國(guó)產(chǎn)藥品走向世界。
截至9月12日,中檢院官網(wǎng)公布了942個(gè)產(chǎn)品的參比制劑備案信息,表明230家制藥公司在今年5-6月間申請(qǐng)或備案了參比制劑。筆者初步分析參比制劑的申請(qǐng)和備案情況,從中一探各制藥公司的下一步規(guī)劃。
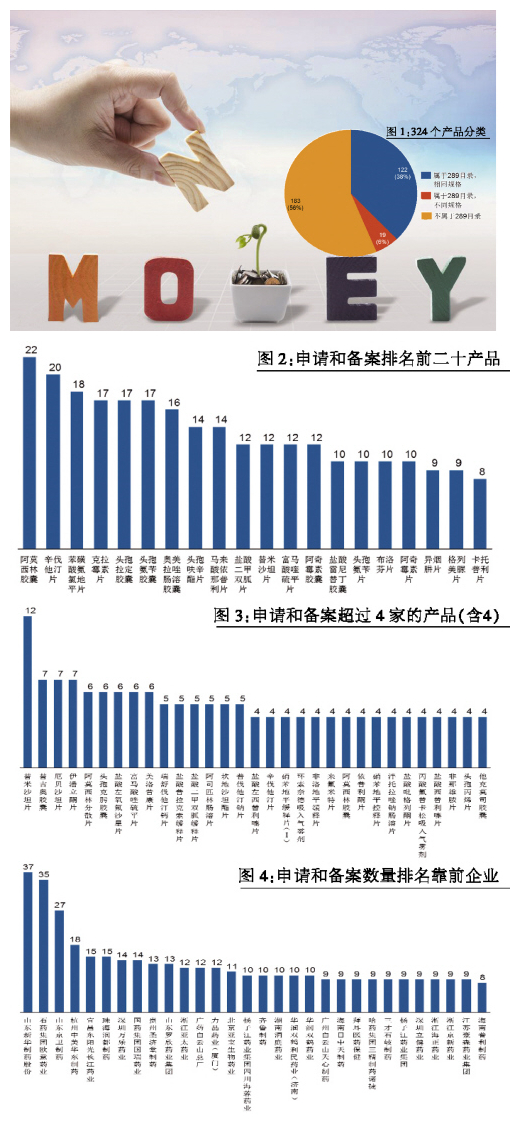
900余條申請(qǐng)和備案情況,涉及324個(gè)產(chǎn)品,屬于此前公布的289個(gè)2018年前要完成一致性評(píng)價(jià)產(chǎn)品目錄的共141個(gè),占比達(dá)44%,其中完成相同產(chǎn)品規(guī)格的122個(gè),既包含相同規(guī)格,又包含不同規(guī)格的產(chǎn)品為19個(gè)。值得注意的是,有183個(gè)不屬于289目錄的參比劑,也被申請(qǐng)和備案,說(shuō)明相關(guān)制藥企業(yè)積極響應(yīng)CFDA政策號(hào)召,提前在布局(見圖1)。
進(jìn)一步分析具體品種,參比劑申請(qǐng)和備案產(chǎn)品的狀態(tài)是比較擁擠的。前20名的產(chǎn)品,都有8家及以上廠家在申請(qǐng)和備案參比劑(見圖2)。其中,阿莫西林膠囊有22個(gè)申請(qǐng),排名第一;辛伐他汀片、氨氯地平片、克拉霉素片、頭孢拉定膠囊、頭孢氨芐膠囊和奧美拉唑膠囊等也有超過(guò)15家以上申請(qǐng),競(jìng)爭(zhēng)激烈。對(duì)于不屬于289目錄的參比制劑,競(jìng)爭(zhēng)相比較稍弱一些,31個(gè)品種有4家及以上申請(qǐng),其中,替米沙坦片排名靠前,有12家申請(qǐng),其次是替吉奧膠囊、厄貝沙坦片、伊潘立酮片等,也有7家申請(qǐng)(見圖3)。
進(jìn)一步分析具體公司申請(qǐng)和備案的情況(未考慮合資公司和子公司),前30名公司都申請(qǐng)了8個(gè)及8個(gè)以上產(chǎn)品(見圖4)。其中,山東新華一共申請(qǐng)了近40個(gè)產(chǎn)品,位列前茅。石藥歐意、山東京衛(wèi)緊隨其后。
還值得關(guān)注的是齊魯制藥、江蘇恒瑞、江蘇豪森和浙江海正,分別申請(qǐng)了10個(gè)、8個(gè)、9個(gè)和9個(gè),這些產(chǎn)品不屬于289目錄的參比劑的比例較大,反映國(guó)內(nèi)制藥公司在一致性評(píng)價(jià)上采用了比較明顯的不同的策略。
正如主管部門相關(guān)負(fù)責(zé)人在此前會(huì)上所表示的,公布需要評(píng)價(jià)的品種目錄,實(shí)際上也是為了讓所有企業(yè)看看,掂量一下做還是不做,進(jìn)而督促藥企盡快推進(jìn)仿制藥一致性評(píng)價(jià)工作的進(jìn)度。有消息稱,主管部門接下來(lái)還可能建立季度表,及時(shí)通報(bào)同品種的評(píng)價(jià)結(jié)果,對(duì)于評(píng)價(jià)進(jìn)展緩慢,可能影響市場(chǎng)供應(yīng)的品種,會(huì)加大資金和技術(shù)引導(dǎo)力度,確保臨床用藥的可及性。如果有企業(yè)不做的,也將公布,考慮列入臨床短缺目錄,鼓勵(lì)其他廠家仿制。
期待盡快會(huì)有下一步的公開通報(bào),可使整個(gè)一致性評(píng)價(jià)工作更加有序地進(jìn)行。
 相關(guān)新聞
相關(guān)新聞