自2016年3月4日,CFDA發布關于化學藥品注冊分類改革工作方案后,中國1類被重新定義為境內外均未上市的創新藥,系指含有新的結構明確的、具有藥理作用的化學物,且具有臨床價值的藥品。在物質基礎原創性和新穎性基礎上,強調臨床療效的同時,也開始與世界接軌。
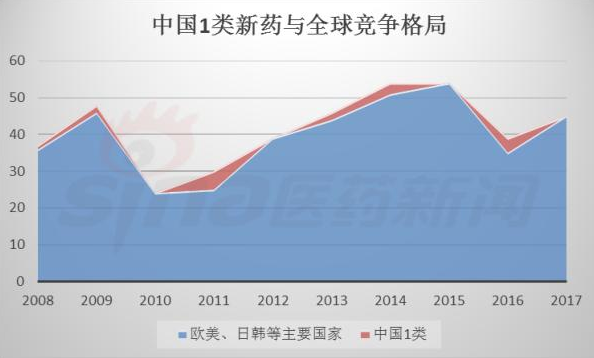
根據藥渡數據索引,自2001年到2016年,CFDA共批準上市1類化學藥13個、生物藥16個。

而全球(歐美、日、韓等主要國家)從2008年到2017年共批準上市化學藥256個、生物藥146(含生物類似藥)個,差距是顯而易見的。
一、臨床申請中的中國1類
截止到2017年11月15日,仍然沒有1類新藥上市,但在新藥上市申請(NDA)階段的1類化藥有9個,適應癥涉及心腦血管、腫瘤、HIV、感染等多個熱門領域。
表1 2017年NDA申請中的中國1類新藥
 >>>>羅沙司他
>>>>羅沙司他
羅沙司他是一種低氧誘導因子脯氨酰羥化酶(HIF-PH)抑制劑,可抑制低氧誘導因子(hypoxia inducible factor,HIF)的泛素化降解,幫助機體產生更多的紅血球。
羅沙司他最初由FibroGen(琺博進)研發,2006年授權給安斯泰來在亞洲,歐洲和南非地區的開發權。2013年授權給阿斯利康美國,中國及除日本,歐洲以外的主要地區的開發權。該化合物2014年4月由北京琺博進醫藥技術申報中國化藥1.1類臨床研究,于2015年8月獲得臨床批件。
>>>>丁磺氨酸
丁磺氨酸在中國由遼寧藍天制藥、復旦大學和上海中敏新技術共同研發,是一種腫瘤化療增敏劑。該化合物于1998年獲得一期新藥臨床證書,1999年獲得二、三期新藥臨床證書,2004年完成二期臨床試驗,2007年完成三期臨床試驗,2011年9月申報生產,審批結論是需補充部分臨床試驗。2014年3月獲得中國化藥1.1類臨床批件。
丁磺氨酸在美國由美國國立癌癥研究所研發,用于治療成神經細胞瘤,目前處于臨床一期。
>>>>苯烯莫德
苯烯莫德于2016年12月提交新藥上市申請(化藥1類),用于治療皮膚炎與牛皮癬。
該化合物最初由Welichem Biotech研發,后授權給施泰福(葛蘭素史克子公司)和天濟藥業。
>>>>呋喹替尼
呋喹替尼最初是由和記黃埔研發,2013年授權給禮來公司合作開發。用于治療胃癌、晚期或轉移性結直腸癌及非小細胞肺癌。2017年6月呋喹替尼治療晚期結直腸癌的NDA申請獲中國食品藥品監督管理局(CFDA)的正式受理。
呋喹替尼是一種高選擇性的血管內皮生長因子受體(VEGFR)口服抑制劑,它有潛力成為全球同類最佳的能夠治療多種實體瘤的VEGFR抑制劑。根據迄今為止的臨床前和臨床研究資料,呋喹替尼的激酶選擇性被證實能夠降低脫靶毒性。該條件下藥物暴露量可以完全抑制VEGFR,且有潛能可以在接受早期治療的更大的患者群體中與其他靶向療法和化療聯合使用(VEGFR是一種有助于腫瘤周圍新生血管生成的受體酪氨酸激酶,從而有助于腫瘤增長)。高效、低毒、適合聯合用藥是呋喹替尼區別于其他已獲批的小分子VEGFR抑制劑的優良特性。
和記黃埔目前正與禮來聯手在中國開展呋喹替尼治療結直腸癌,非小細胞肺癌和胃癌的各項研究。此外,還在蘇州設立了工廠,并配備了一整套制劑生產設施,負責生產供應呋喹替尼膠囊。
>>>>馬來酸吡咯替尼
馬來酸吡咯替尼由江蘇恒瑞研發,2017年8月在中國提交上市申請,用于治療HER2陽性的轉移性乳腺癌。2011年5月,江蘇恒瑞醫藥和上海恒瑞醫藥聯合向CFDA提交臨床試驗申請(化藥1.1),并于2012年4月獲得中國化藥1.1類臨床批件。
>>>>艾博衛泰
艾博衛泰是一種人類免疫缺陷病毒(HIV-1)融合抑制劑,對主要流行的HIV-1病毒以及耐藥病毒均有效,治療已接受過抗病毒藥物治療的HIV-1感染者。2016年7月,前沿生物向CFDA提交NDA申請(化藥1類)。
>>>>丹諾瑞韋鈉
丹諾瑞韋鈉于2016年12月在中國提交NDA申請,HCV蛋白抑制劑,與聚乙二醇干擾素、利巴韋林和利托那韋聯合治療丙肝感染。該化合物最初由InterMune開發(研發代碼為ITMN-191、ITMN-B),2006年授權給羅氏(研發代碼為R-7227、RG-7227、RO-5190591),2010年該協議終止,羅氏獲得該藥物的研發權,2014年,InterMune被羅氏收購;2013年,羅氏將中國及臺灣的研發權授權給歌禮(研發代碼為ASC-08、AR-00334191、AR-334191)。
>>>>可利霉素
可利霉素是一種治療細菌感染的大環內酯類抗生素。可利霉素由中國醫學科學院醫藥生物技術研究所研發,已轉讓給沈陽同聯制藥集團。該化合物于2010年9月由中國醫學科學院醫藥生物技術研究所、沈陽同聯和北京首科集團共同申報1.1類新藥。
>>>>鹽酸去甲烏藥堿
鹽酸去甲烏藥堿處于申報生產在審批期,β腎上腺素受體激動劑,用于治療冠心病。2012年8月,珠海潤都制藥,廣東華南新藥創制中心和中國醫學科學院藥物研究所聯合申報中國化藥1.1類生產審評。
在生物制品許可申請(BLA)中的生物藥有2品種,有望明年上市。
表2 2017年BLA申請中的生物藥
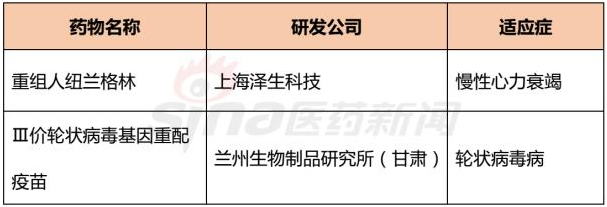 >>>>重組人紐蘭格林
>>>>重組人紐蘭格林
重組人紐蘭格林是一種重組蛋白藥物,來源于人體內自然存在的Neuregulin-1的活性多肽片段,可通過與心肌細胞表面的表皮生長因子受體家族成員ErbB4受體結合,介導ErbB2/ErbB4異源二聚體的形成,激活下游一系列信號通路,發揮修復心肌細胞結構、改善心臟功能的作用。 該藥可用于治療中重度慢性心力衰竭(CHF)。
重組人紐蘭格林最初由上海澤生科技開發有限公司開發,2013年SciClone公司獲得了該藥物在中國、香港和澳門的商業化授權。2012年4月,上海澤生科技向CFDA遞交了重組人紐蘭格林的生產申請(治療用生物制品1類)。
>>>>Ⅲ 價輪狀病毒基因重配疫苗
蘭州生物制品研究所研發的Ⅲ價輪狀病毒基因重配疫苗,用于預防輪狀病毒感染。2016年11月,蘭州生物制品研究所向CFDA提交了該疫苗的生產申請(預防用生物制品1類)。
二、臨床在研階段的中國1類
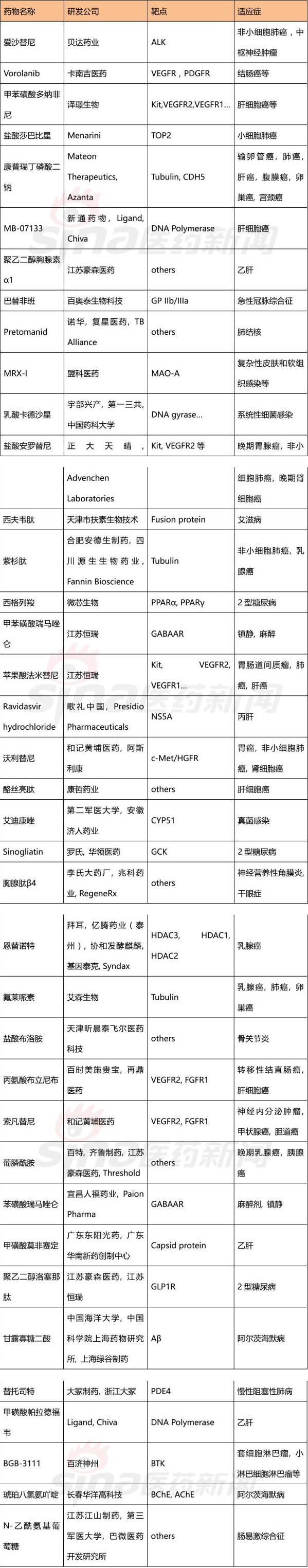
截止到2017年11月15日,臨床在研階段的1類新藥有506個,其中處于臨床三期的有52個、臨床二期的有75個、臨床一期的有300個以及臨床申請中有79個。
以下是對處于臨床三期的化學藥和生物藥的列舉。
表3 處于三期臨床試驗的10品種生物藥
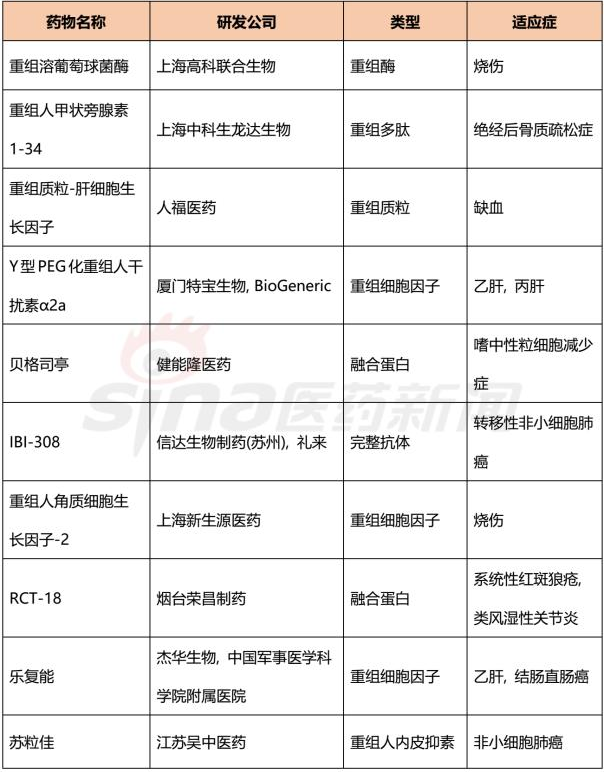
表4 處于三期臨床試驗的38品種化學藥
本文數據來源:藥渡數據Pro V2.0














 相關新聞
相關新聞