總局辦公廳關于開展仿制藥質量和療效一致性評價生物等效性試驗培訓的通知
總局辦公廳關于開展仿制藥質量和療效一致性評價生物等效性試驗培訓的通知
食藥監辦藥化管函〔2017〕86號
各省、自治區、直轄市食品藥品監督管理局,中央軍委后勤保障部衛生局、中國人民武裝警察部隊后勤部衛生局:
為進一步推動仿制藥質量和療效一致性評價工作順利開展,食品藥品監管總局將開展仿制藥質量和療效一致性評價生物等效性試驗培訓。現將有關事宜通知如下:
一、培訓時間和地點
分兩次開展培訓,培訓時間和地點分別為:
2017年2月17日8:30—18:00 重慶市
2017年2月28日8:30—18:00 北京市
二、培訓內容
兩次培訓內容一致,包括生物等效性試驗的設計、管理、生物樣本分析、數據核查等內容。
三、培訓對象
主要面向藥物臨床試驗機構。
四、報名方式
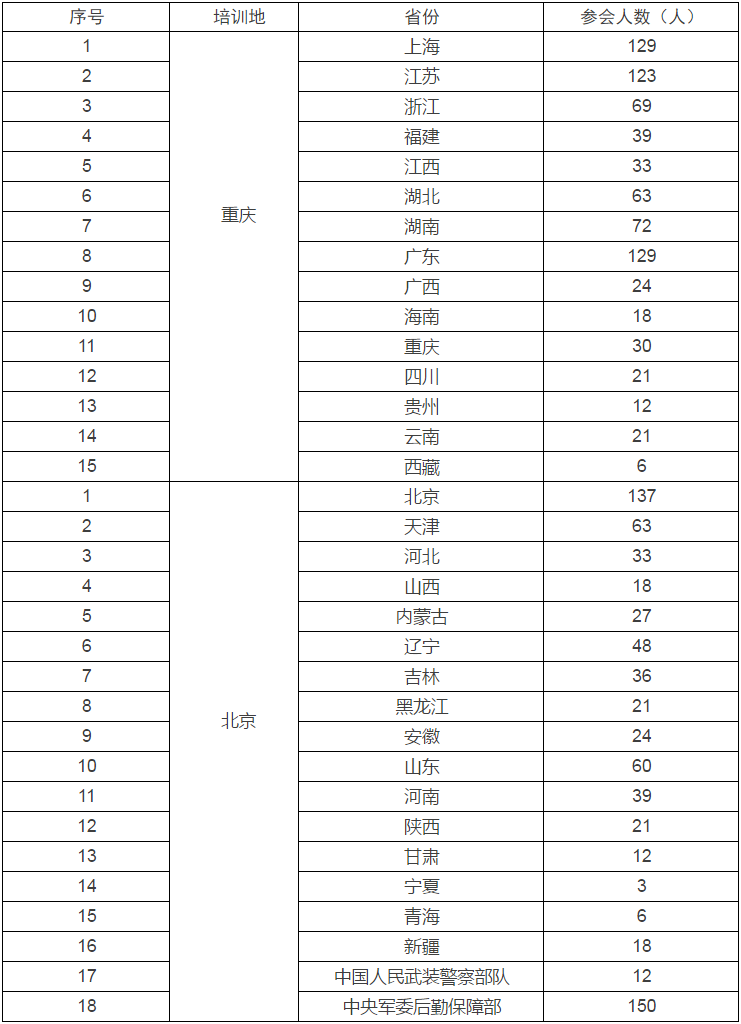
本次報名分南方地區和北方地區,參會省份及人數見附件1。請各省食品藥品監管局按每個藥物臨床試驗機構2—3人通知參會,按附件2格式匯總報名信息,于2017年2月15日前報給培訓地省食品藥品監管局聯系人。
未盡事宜請聯系培訓地省局聯系人。
五、其他要求
(一)本次培訓由食品藥品監管總局主辦,由培訓地食品藥品監管局承辦。請培訓地食品藥品監管局認真做好培訓報名的組織工作,落實好培訓的各項事宜。
(二)本次培訓不收取培訓費用。參訓人員食宿、交通費用自理。
(三)培訓期間嚴格執行中央“八項規定”和國家相關的會議管理規定。
六、聯系方式
重慶市食品藥品監督管理局:蔣榮金(電話:023-60353882,郵箱:754264654@qq.com)
北京市食品藥品監督管理局:劉悅(電話:010-83979465,電子郵箱:bjzhucechu@163.com)
國家食品藥品監督管理總局:荊淑芳(電話:010-88330797)
附件:1.各省參會人數
2.培訓報名表
食品藥品監管總局辦公廳
2017年2月13日
附件1.各省參會人數.docx
附件2.培訓報名表.docx

分享到:









 相關新聞
相關新聞