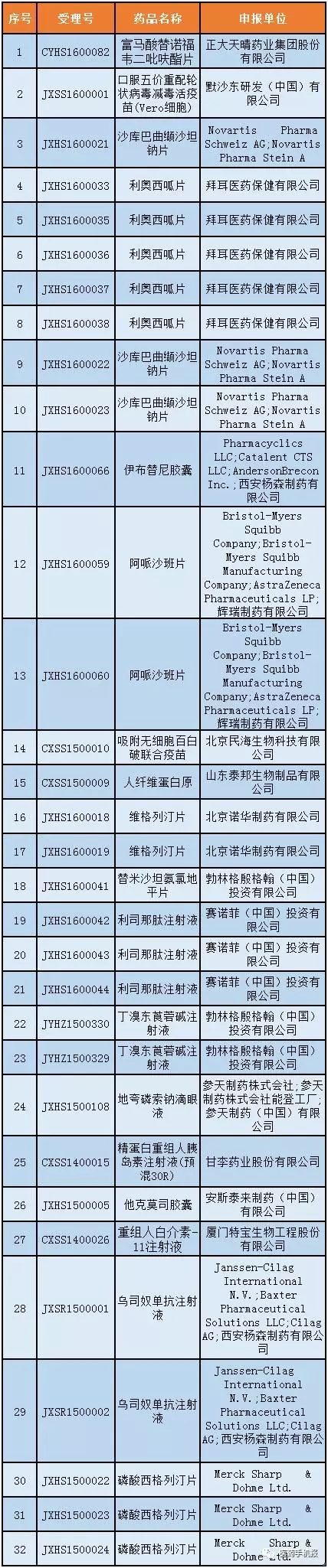
3月3日,國家藥監(jiān)總局食品藥品審核查驗中心發(fā)布《藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃公告(第10號)》,計劃對富馬酸替諾福韋二吡呋酯片(受理號:CYHS1600082)等32個藥物臨床試驗數(shù)據(jù)自查核查品種開展現(xiàn)場核查。
公示期結(jié)束后,即3月16日后對上述藥品開展現(xiàn)場核查。
依照國家藥監(jiān)總局于2016年3月29日印發(fā)的《藥物臨床試驗數(shù)據(jù)核查工作程序(暫行)》,藥品注冊申請人在公示后10個工作日內(nèi)未提出撤回申請的視為接受現(xiàn)場核查。
對于接受現(xiàn)場核查的品種,國家藥監(jiān)總局作出審批決定后,將對現(xiàn)場核查發(fā)現(xiàn)問題而不予批準(zhǔn)的藥品注冊申請相關(guān)情況予以公告;對涉嫌弄虛作假的立案調(diào)查。誰會“中槍”呢?
另據(jù)悉,截至目前,國家藥監(jiān)總局食品藥品審核查驗中心共發(fā)布了10批現(xiàn)場核查計劃!
以下為前九批核查名單:
第1號:16個
公示期:2016年3月30日-4月13日。
第2號:20個
公示期:2016年5月4日-5月17日。
第3號:1個
公示期:2016年6月12日-6月23日。
受理號:CXSS1300020
藥品名稱:腸道病毒 71 型滅活疫苗(Vero 細(xì)胞)
申報單位:武漢生物制品研究所有限責(zé)任公司、國藥中生生物技術(shù)研究院有限公司
第4號:32個
公示期:2016年7月8日至7月21日
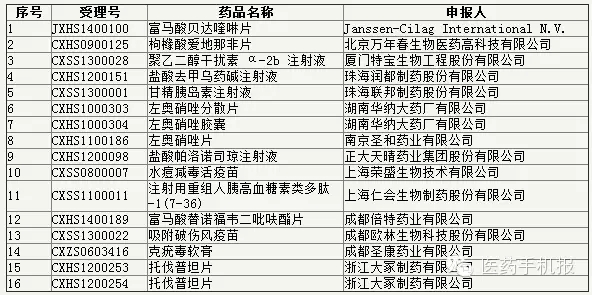
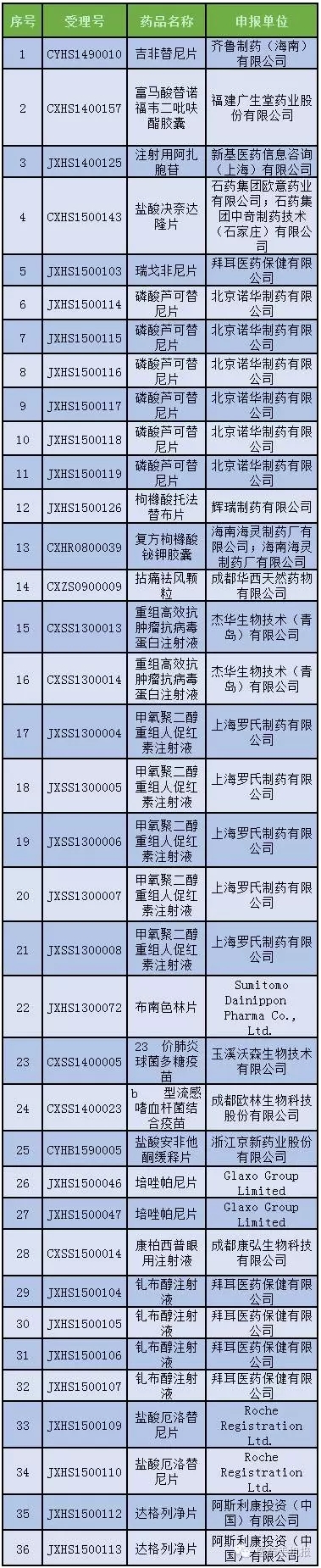
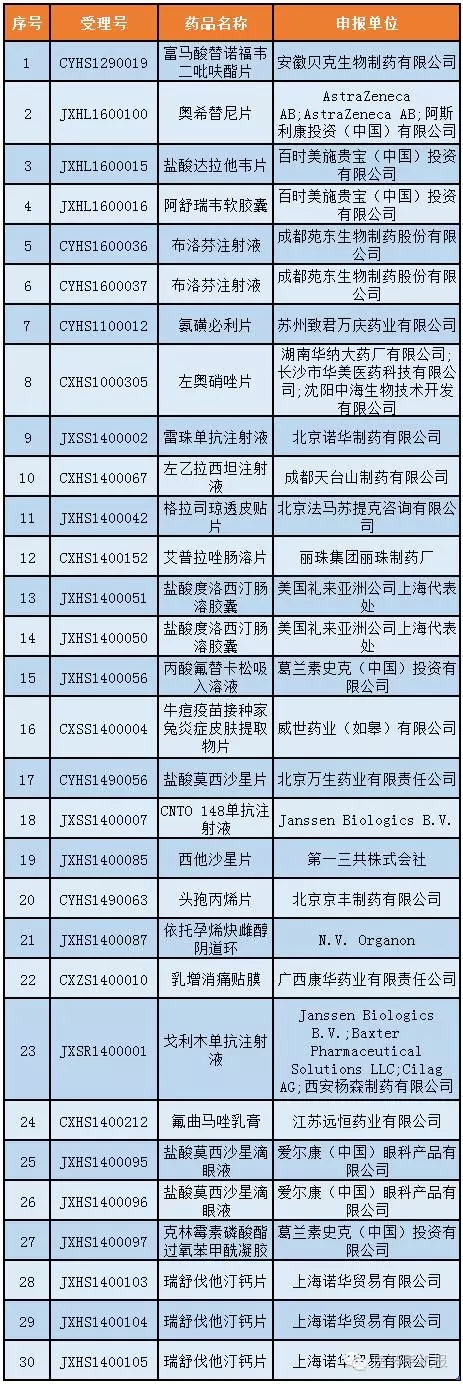
第5號:36個
公示期:2016年8月9日至9月1日
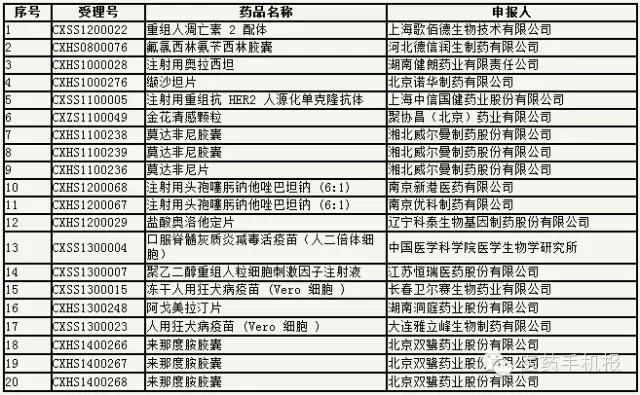
第6號:30個
公示期:2016年9月14日至9月28日
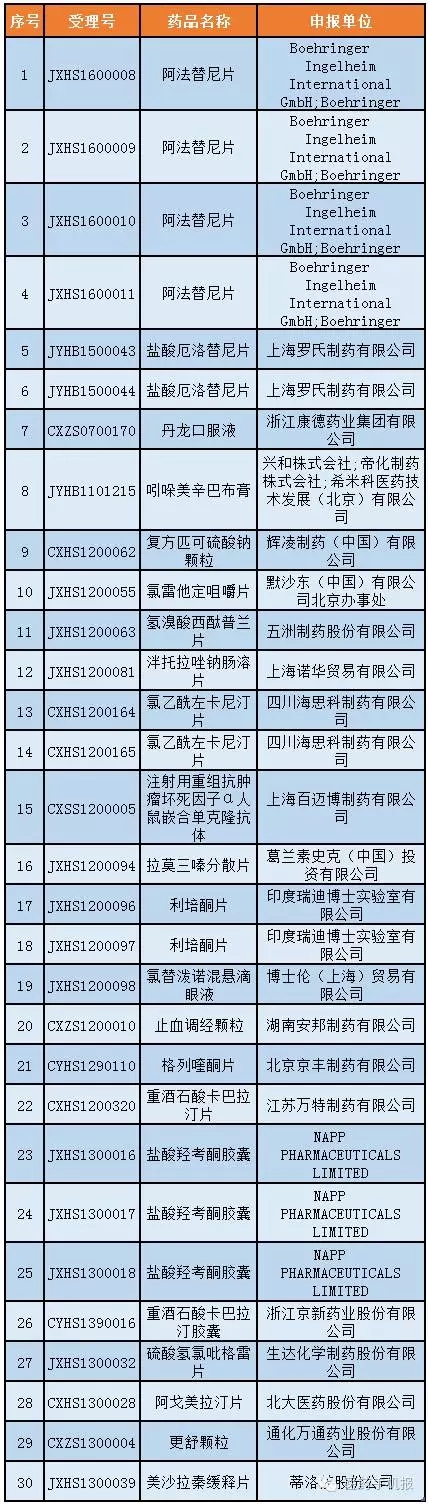
第七號:50個
公示期:2016年10月22日至11月4日
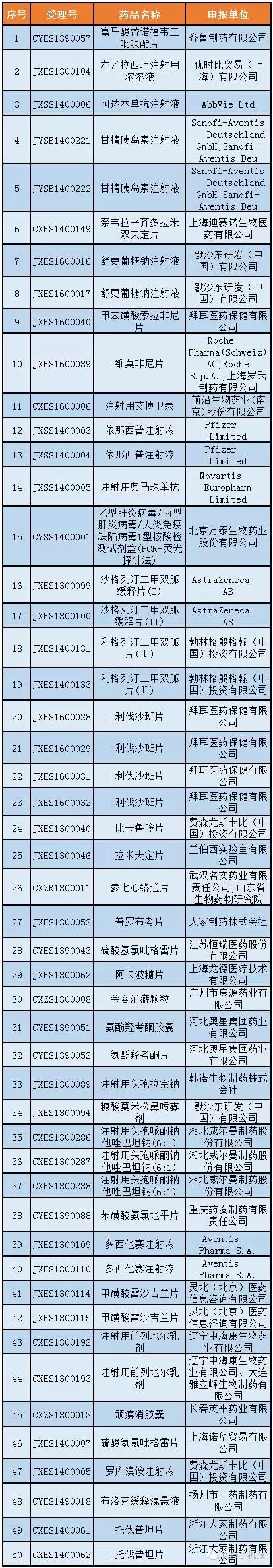
第8號:30個
公示期:2016年11月30日至12月13日
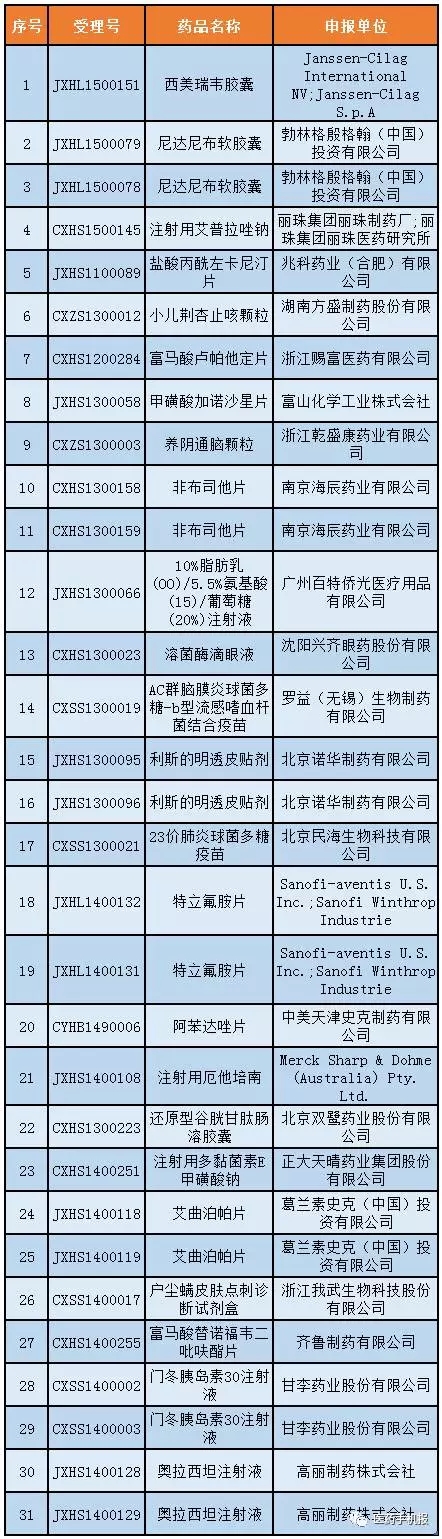
第九號:31個
公示期:2017年1月13日至1月25日