



業務咨詢
中國:
Email: marketing@medicilon.com.cn
業務咨詢專線:400-780-8018
(僅限服務咨詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




“乘風破浪”最近制造了不少國民話題,屢次登上熱搜吸引人的眼球。然而能乘風破浪的不只姐姐,在醫藥圈里,2022年核酸藥物的翻紅亦是家喻戶曉,令人矚目。
回顧核酸藥物的成名史,閃光點和挫折共同譜寫出獨屬于她的璀璨樂章:
1961年,mRNA作為遺傳物質傳遞信息的機制被發現,這一完美模仿并演繹的天賦為她日后成長為實力派演員打下了必不可少的基礎;
1978年,她推出了概念為反義寡核苷酸ASO的作品,可惜該作品因超越時代而沒有迅速打開市場,卻不妨礙其成為不少人心中的經典之作;
而后數十年中,受限于免疫原性的政策打壓和遞送系統的曝光降低,她漸漸消失在了大眾的視線中。
人們說,她被雪藏了。但她與沒有放棄她的團隊和粉絲一起,在續寫一個奇跡!
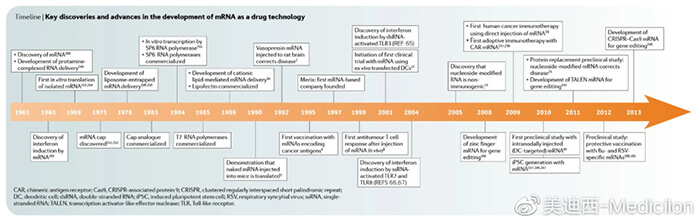
圖1 核酸藥物的發展歷程[1]
1990年,她的Aptamer在小鼠群體中成功表達,引起巨大反響,標志著她踏出了復出事業的第一步;
1998年,她曾經的經典之作ASO獲批上市走向大眾,同時她也開發出了新的特長RNA干擾技術,獲得了更好的資源和機會;
2006年,憑借著RNA干擾技術,她再一次登上了諾貝爾獎的頒獎臺,正式宣告她的王者歸來;
2020年,BioNtech與Pfizer聯合出品的首個mRNA新冠疫苗拉開了新時代的帷幕,她就是所有人矚目的明星;
2022年,Moderna用凈利潤122億美元的財報數據證實了以mRNA疫苗為代表的核酸藥物的市場價值……
就像多年沉淀種下的種子終于結果,近年來多款重磅作品如雨后春筍般相繼問世,核酸藥物終于在21世紀迎來了自己的高光時刻。
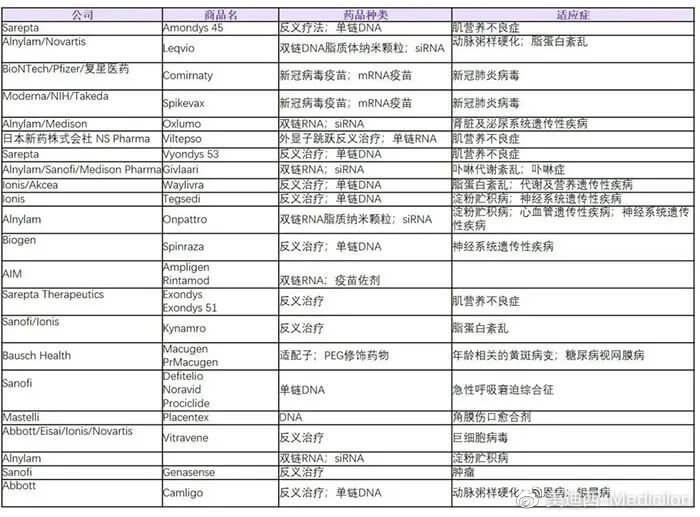
圖2 截至目前全球已獲批的核酸類藥物列表(數據來源:科睿唯安)
能獲得如此耀眼的成就,離不開核酸藥物自身獨一無二的特點和優勢。
候選靶點豐富
她涉足領域極其廣泛,并不拘泥于單一風格,感染性疾病疫苗(預防性疫苗)、腫瘤治療(治療性疫苗)、蛋白替代療法(治療性藥物)均有涉獵。
這是因為核酸藥物作用的基本原理遵從堿基互補原理對表達相關蛋白質的基因,換而言之,任何由特定基因表達引起的疾病都可以通過核酸藥物進行靶向治療。而且與小分子化藥和抗體藥物相比,核酸藥物沒有靶點無法成藥的限制,對細胞內外和細胞膜蛋白均可發揮調節作用。大量沒有對應藥物的靶點化作級級臺階,為核酸藥物鋪出一條加冕為王的星光大道,她,擁有無限可能。
分子設計便捷
她還以效率高著稱,往往能夠有的放矢,事半功倍。
核酸藥物的設計擺脫了傳統藥物需要大規模篩選和優化的漫長周期,只需要知道靶點基因的堿基序列,根據互補原則設計即可,極大加速了藥物研發和商業化的進程。
圖3 核酸藥物的研發策略與傳統藥物研發相比更加快速直觀[2]
藥物作用長效
她的作品流傳度廣,總能留下深遠的影響,經久不衰。這一特點在siRNA藥物也有體現,就算靶標被降解后,RNA誘導的沉默復合體(RISC)依然可以循環工作,使得核酸藥物在細胞內較長時間地發揮作用,延長給藥周期,不易產生耐藥性。
盡管如此,核酸藥物的奮斗路上也不是一帆風順的,好在貴人相助,才得以再次揚帆起航。第一個貴人就是化學修飾技術。核酸藥物早年的受眾反響風評并不穩定,極易被清除降解,口碑很難發酵,好在化學修飾技術出現為她進行了優化包裝,對容易“招黑”的堿基、糖環和連接基團磷酸稍作改造,從而克服核酸藥物的不穩定性,并增強了某些優勢和功能。
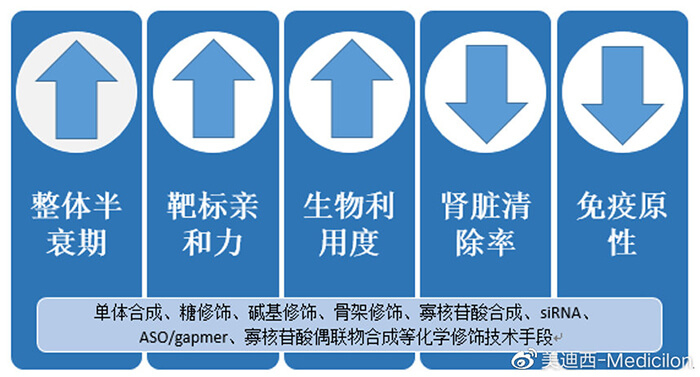
圖4 化學修飾技術對核酸藥物的影響
磷酸骨架:針對磷酸骨架最常用的化學修飾是硫代磷酸,即將核苷酸中磷酸骨架中的一個非橋氧用硫進行替代,可以抵抗核酸酶的降解,提高核酸藥物在人體內的穩定性。而且該改造可增強其與血漿蛋白的結合能力,降低腎臟清除速率,提高半衰期。
核糖:對核糖結構的改造屬于第二代化學修飾技術,常見的方法有2'-F、2'-OMe和2'-MOE等,這些改造可以增強其與互補核苷酸鏈的結合能力,大大提高了核酸的穩定性和整體半衰期。
核糖五元環:第三代化學修飾技術是對核糖五元環進行改造,包括LNA、PNA、PMO,這些改造使核酸藥物與一些基團進行共價,在增強核酸藥物對核酸酶的抵抗、提高親和力和特異性的同時,也提高了核酸藥物進入細胞的效率。化學修飾就像是核酸藥物的良師益友,指導并幫助她通過“生物分析”考核,在穩定性、免疫原性、整體半衰期等重重關卡中獲得不俗的成績,也為核酸藥物后期成藥打下了結實的基礎。
第二個貴人是藥物遞送技術。藥物遞送系統的革新對核酸藥物的發展是意義重大的一步,他們就像核酸藥物的經紀人一樣,安排的通告計劃能有效提高核酸藥物對于受眾的曝光度,護送核酸藥物能安全順利到達活動地點,提高核酸藥物進入細胞的效率。
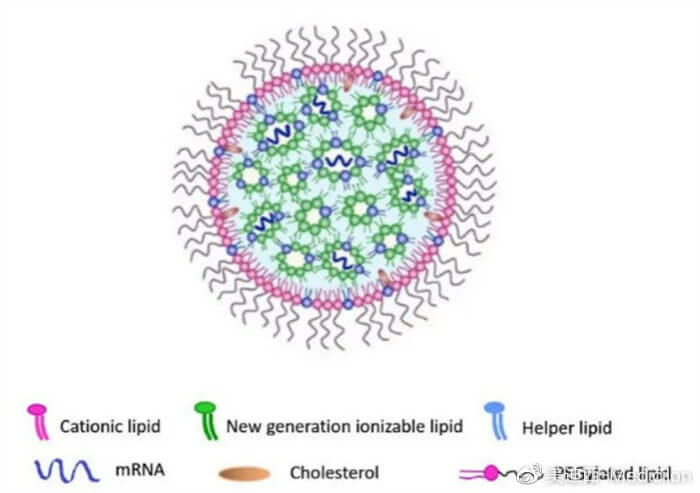
圖5 在脂質納米顆粒的保護下,核酸藥物的傳遞效率更高[3]
盡管遞送系統極大促進了核酸藥物的發展,由于脂質類遞送系統(LNP)體積較大,容易進入肝、腎的空隙較大的組織,且依然存在免疫原性,目前最常用的遞送系統是GalNac偶聯技術。例如Alnylam公司參與開發的3款已經上市的siRNA藥物都是基于GalNAc偶聯技術遞送系統開發的。
然而,翻紅的熱度是否能夠經過時間和市場的考驗,成為能夠登頂成團的冠軍,還需要經過磨礪和檢驗。除了上文中提到的“生物分析”外,核酸藥物還要面對“臨床前研究”考核制度,還有“藥效評價”、“藥物安全性評價”共三個大方向的成團考核,只有在考核中取得了優異的成績,核酸藥物才能登頂奪冠,順利成藥。

圖6 核酸藥物的QPCR基因表達檢測技術(圖源美迪西)
另外,核酸藥物以內吞體進入細胞的機制會面對的逃逸問題仍是核酸藥物“出圈”的瓶頸。雖然已經有利用蜂毒素、CPP、氯喹等的解決方案,但都由于毒性安全問題而擱淺。因此內吞體逃逸就是核酸藥物耀眼機遇面前最大的挑戰,也是我們需要關注和討論的話題。
為了更好地助力核酸藥物事業,美迪西將聯合一部分行業內核酸藥物的領跑企業于2022年07月08日下午13:00-17:00開展一場關于核酸藥物的線上論壇。
這是一場干貨滿滿的知識盛宴,是一場關乎核酸藥物未來的頭腦風暴,更是一場值得每一位醫藥人士參與的驚喜約“會”!
云上圓桌零距離參與大咖討論,參會更有500元京東卡等你贏取!
論壇采取邀請審核制,免費注冊即可觀看。

參考文獻:
[1] Sahin, U., Karikó, K. & Türeci, ?. mRNA-based therapeutics — developing a new class of drugs. Nat Rev Drug Discov 13, 759–780 (2014). https://doi.org/10.1038/nrd4278[2] Mollocana-Lara EC, Ni M, Agathos SN, Gonzales-Zubiate FA. The infinite possibilities of RNA therapeutics. J Ind Microbiol Biotechnol. 2021;48(9-10):kuab063.
[3] Aldosari et al., (2021). Lipid Nanoparticles as Delivery Systems for RNA-Based Vaccines. Pharmaceutics, https://doi.org/10.3390/pharmac
 相關新聞
相關新聞