



業務咨詢
中國:
Email: marketing@medicilon.com.cn
業務咨詢專線:400-780-8018
(僅限服務咨詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




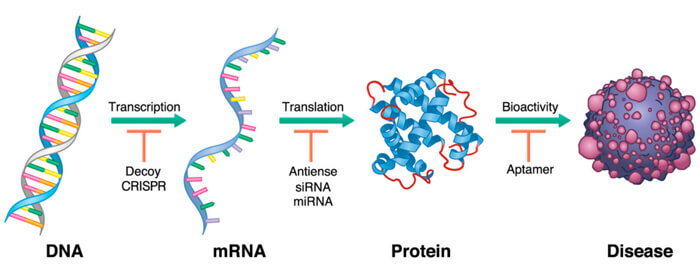
寡核苷酸藥物作用于病理基因表達的不同階段[1]
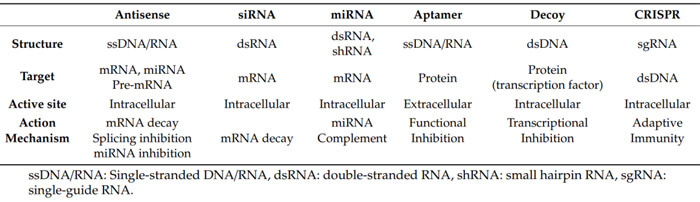
寡核苷酸藥物分類[1]
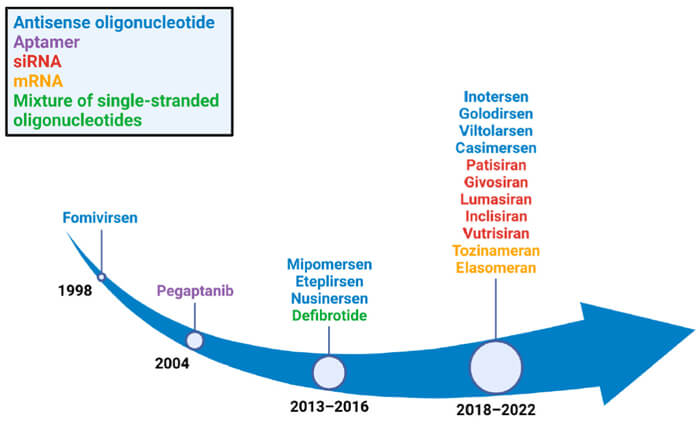
已獲批的核酸藥物[2]
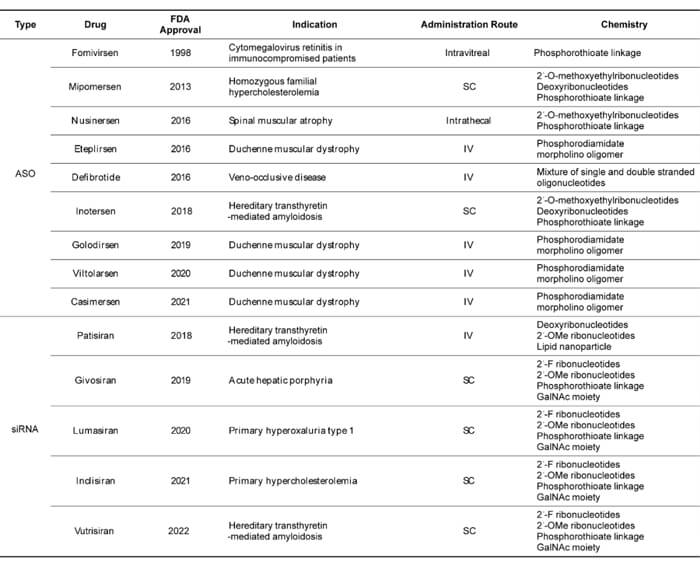
已獲批的寡核苷酸藥物 (截至2022年6月)[2]
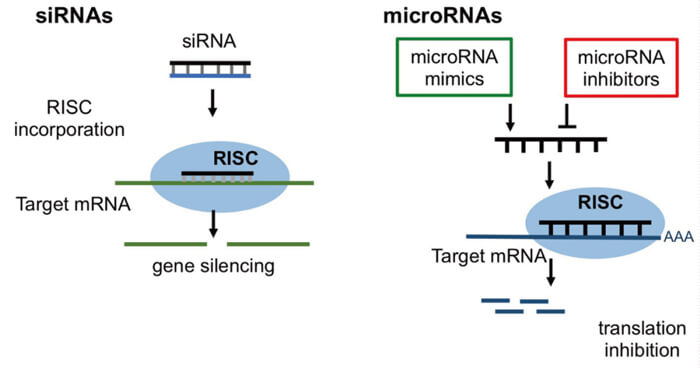
RNAi的作用機制[3]
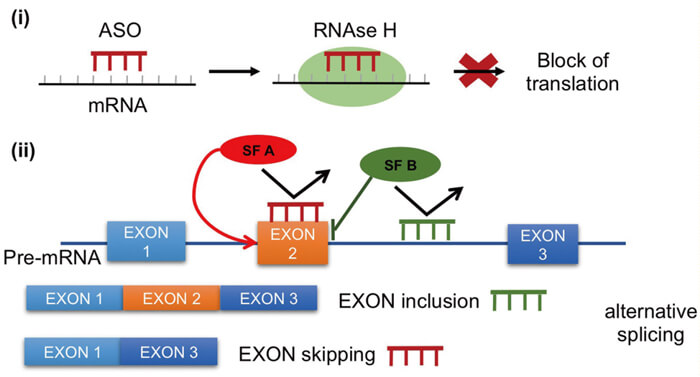
ASO 藥物作用機制[3]
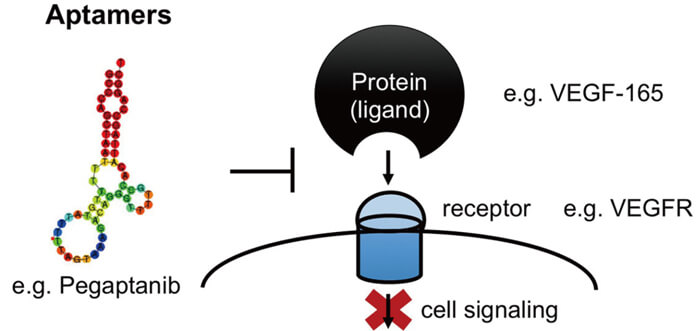
核酸適配體的作用機理[3]
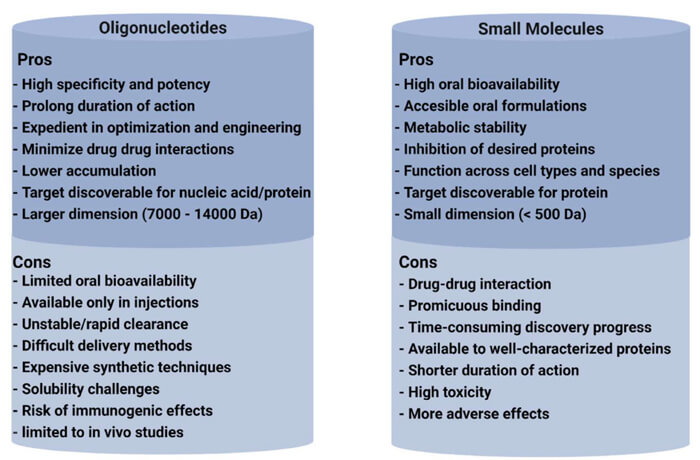
寡核苷酸與小分子藥物的優缺點比較[4]
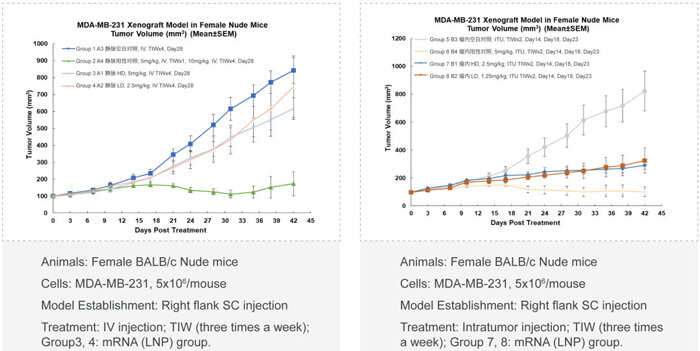
? 不同用藥途徑的比較(如靜脈注射,瘤內局部注射)
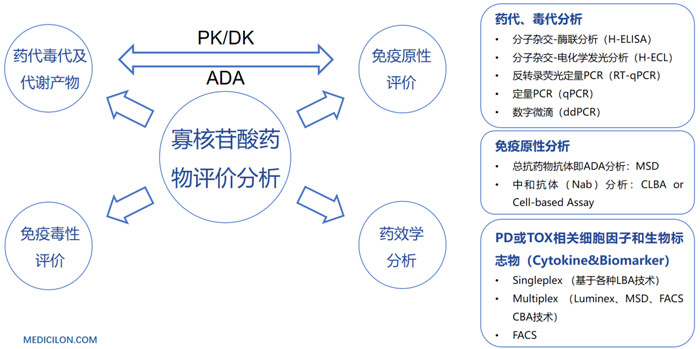
? 體內藥效與靶標mRNA/蛋白質降解(PD)和寡核苷酸藥物的系統暴露量(PK)的相關性分析
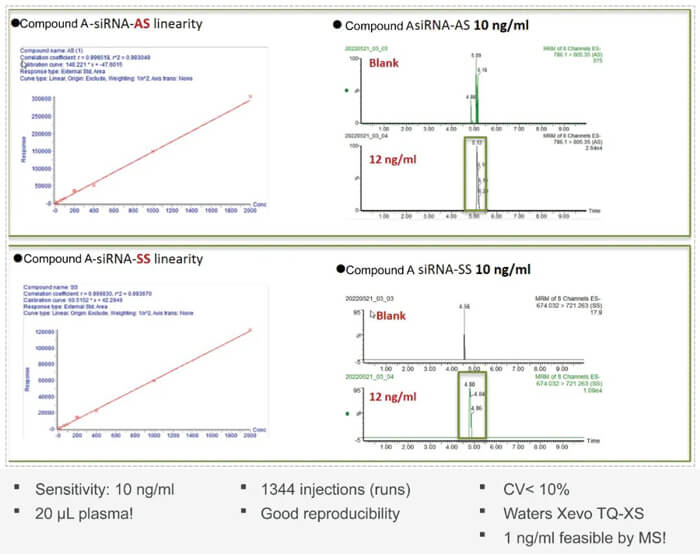
寡核苷酸藥物開發過程中藥代動力學PK方面的挑戰也是此類藥物較大的難題。未經修飾的寡核苷酸類藥物成藥性不佳;PK特性差;穩定性差;容易被核酸酶降解;分布特性差;和靶標的結合力不佳;生物分析方法開發難度大等。
通過化學修飾和遞送系統可以解決這些問題。隨著技術突破,部分難題目前得到較好的解決辦法,其中化學修飾可以避免核酸類藥物被核酸酶降解并延長半衰期,高效安全的遞送系統可以使寡核苷酸類藥物精準的靶向器官,比如肝臟,并提高細胞攝取效率,使寡核苷酸類藥物發揮較好的治療功能。寡核苷酸藥物從轉錄后水平進行治療,能針對難以成藥的特殊蛋白靶點實現突破,有望攻克尚無藥物治療的疾病包括遺傳性疾病和其他難治性疾病。
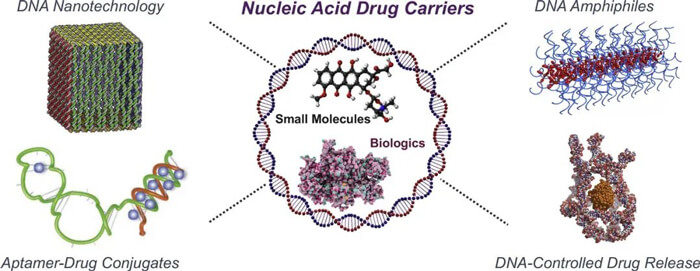
核酸藥物遞送壁壘[5]
美迪西藥代動力學團隊具備完善的寡核苷酸生物分析平臺、肝臟活體穿刺、肌肉活檢和鞘內注射平臺用于PK和PK/PD研究。
基因療法和核酸藥物的發展使得建立猴模型并開展相關研究成為熱點。因基因、形態學、生理生化等特點與人類高度近似,使得非人靈長類(尤其是食蟹猴)與人類在進化關系上最為接近,在模型構建、疾病機制研究以及藥物研發方面優勢突出。目前已經建立了多種疾病模型。
在進行食蟹猴肝臟疾病模型變化的長期動態實驗觀察中,由于受到動物疾病模型與實驗客觀條件的限制,在對這些疾病模型的病理分析和診斷時,科研人員大多通過盲穿或手術或安樂死取材的方法得到肝組織,不僅對動物創傷大、術后護理復雜,且易導致各類并發癥,不利于疾病模型的長期觀察。
而美迪西食蟹猴B超引導下肝臟活體穿刺平臺能夠最大程度地避開大血管及膽囊,具有創傷小、穿刺操作安全簡便、定位準確、術后恢復較好等優勢。B超引導下肝臟活體穿刺平臺可實時動態顯示活檢針進針取材的全過程,大大提高了穿刺的成功率和實驗結果的準確性,同時也促進了實驗動物福利的完善,已經多次應用于基因治療藥物的臨床前體內PK和PK/PD評價項目,并在同一個體動物上不同時間點實現連續采集多份肝臟樣品。
同時,食蟹猴肌肉活檢平臺同樣可實現在同一個體動物上連續采集多份肌肉樣品;對于神經系統治療藥物,局部鞘內注射平臺實現局部治療,都能夠為基因療法和核酸藥物臨床前PK和PK/PD評價提供有力支持。
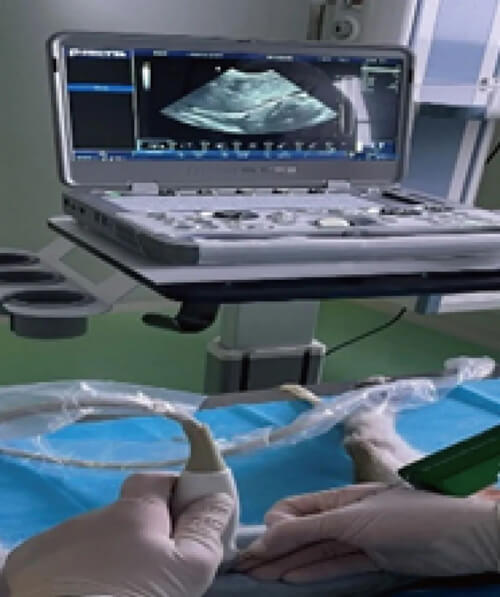
美迪西DMPK部門開展食蟹猴肝臟穿刺活檢用于PK/PD研究
寡核苷酸藥物具有特異性強、設計便捷、研發周期短、靶點豐富等優點,是當前生物醫藥領域研究的重點。同時遞送技術的發展與創新不斷促進核酸藥物給藥途徑的進步。核酸藥物遞送平臺(偶聯遞送系統、納米顆粒載體等)的開發將推動遞送技術和多種給藥途徑(如:皮下注射、靜脈注射、霧化吸入、瘤內注射等)的共同發展。
未來,隨著寡核苷酸藥物的應用領域和技術領域不斷突破創新,技術的更新將有助于寡核苷酸藥物的發展。市場需求和市場規模將持續擴大,寡核苷酸藥物的適應癥范圍廣,包括腫瘤、罕見病、病毒性疾病、腎臟疾病、心血管疾病、炎癥類疾病、代謝類疾病等。因此,寡核苷酸藥物潛在適應人群基數大,隨著技術的發展和生產的成熟,寡核苷酸藥物市場在未來將有更廣闊的發展空間。
[1] Kazuki Takakura, et al. The Clinical Potential of Oligonucleotide Therapeutics against Pancreatic Cancer. Int J Mol Sci. 2019 Jul 6;20(13):3331. doi: 10.3390/ijms20133331.
[3] Ageliki Laina, et al. RNA Therapeutics in Cardiovascular Precision Medicine. Front Physiol. 2018 Jul 25;9:953. doi: 10.3389/fphys.2018.00953. eCollection 2018.
[4] Phuc Tran, et al. Delivery of Oligonucleotides: Efficiency with Lipid Conjugation and Clinical Outcome. Pharmaceutics. 2022 Feb 1;14(2):342. doi: 10.3390/pharmaceutics14020342.
[2] Seong Jun Jo, et al. Clinical Pharmacokinetics of Approved RNA Therapeutics. Int J Mol Sci. 2023 Jan 1;24(1):746. doi: 10.3390/ijms24010746.
[5] Xuyu Tan, etal. Nucleic acid-based drug delivery strategies. JControl Release. 2020 Jul 10;323:240-252.
[6] David Bumcrot, et al. RNAi therapeutics: a potential new class of pharmaceutical drugs. Nat Chem Biol. 2006 Dec;2(12):711-9. doi: 10.1038/nchembio839.