



業(yè)務(wù)咨詢
中國:
Email: marketing@medicilon.com.cn
業(yè)務(wù)咨詢專線:400-780-8018
(僅限服務(wù)咨詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




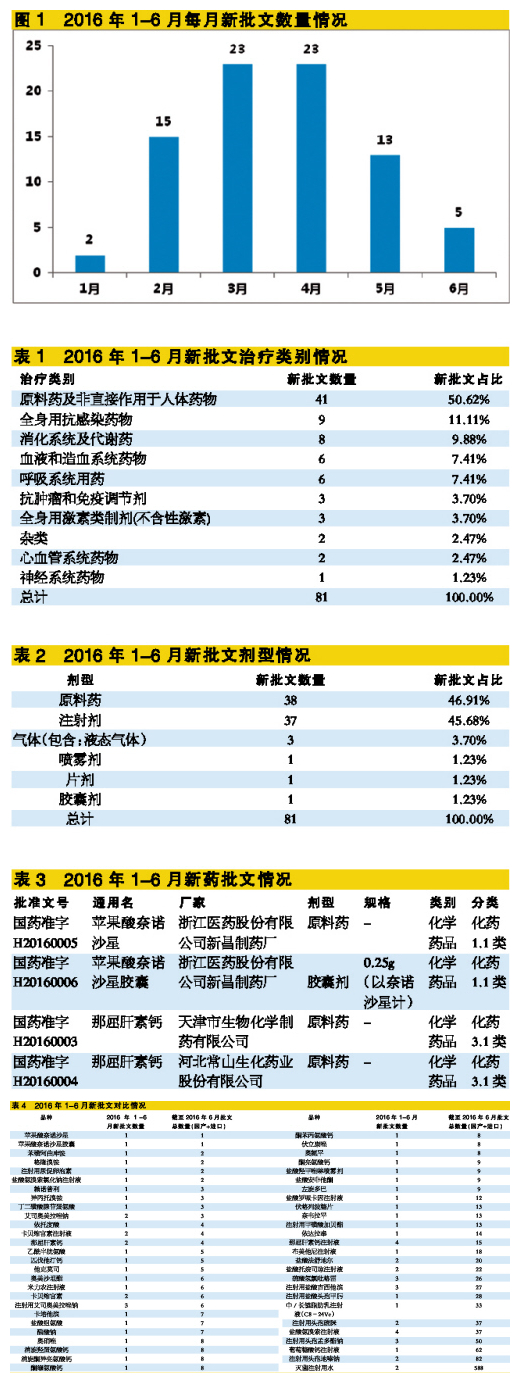
根據(jù)CFDA公布的信息,2016年1-6月共批出81個新國產(chǎn)批文,這81個新批文共涉及55個通用名。所有新批文全是化學(xué)藥品,中成藥和生物制劑沒有一個新批文出現(xiàn)。按注冊分類統(tǒng)計,只有2個1.1類新藥批文和2個3.1類新藥批文,其它批文全部都是6類。
從每月新批出的批文數(shù)量看,3月和4月都批出了23個新批文,但到了5月和6月,新批文數(shù)量明顯減少。
按藥物治療類別劃分,有41個新批文屬于原料藥及非直接作用于人體藥物,占比超過50%。全身用抗感染藥物有9個新批文出現(xiàn),占比11.11%。消化系統(tǒng)及代謝藥有8個新批文,占比9.88%。血液和造血系統(tǒng)藥物、呼吸系統(tǒng)用藥各有6個新批文。
按劑型統(tǒng)計,原料藥新批文最多,有38個,占比46.91%;注射劑排名第二,有37個新批文,占比45.68%。口服用藥劑型只有2個(片劑和膠囊劑各一個),主要原因是2015年CFDA發(fā)布《關(guān)于開展藥物臨床試驗數(shù)據(jù)自查核查工作的公告》(2015年第117號)要求企業(yè)對申請藥品的臨床數(shù)據(jù)做一次徹底的自查,而大部分申請藥物都需要臨床試驗,所以都必須自查核查。然而,相對于其它用藥途徑,部分注射劑是可以申請免臨床研究。
按總批文數(shù)量統(tǒng)計,只有16個通用名的品種現(xiàn)有總批文數(shù)量少于5個。現(xiàn)有批文數(shù)量較少的品種,新廠家獲得批文后進(jìn)入市場后或能改變相關(guān)品種的市場格局。批文數(shù)量較多的品種,市場上廠家較多,競爭激烈,市場格局或已定型,新廠家進(jìn)入市場難度較大。
 相關(guān)新聞
相關(guān)新聞