



業(yè)務(wù)咨詢
中國:
Email: marketing@medicilon.com.cn
業(yè)務(wù)咨詢專線:400-780-8018
(僅限服務(wù)咨詢,其他事宜請(qǐng)撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




全球ADC藥物研發(fā)和投資熱度不斷升級(jí)。因其良好的靶向性和明顯的臨床療效,ADC已經(jīng)成為抗體藥物研發(fā)的前沿。隨著技術(shù)的進(jìn)步,ADC不僅在結(jié)構(gòu)上已突破經(jīng)典的抗體+連接子+小分子毒素模式,核素偶聯(lián)藥物、多肽偶聯(lián)藥物、雙環(huán)肽偶聯(lián)、抗體-siRNA偶聯(lián)物、多靶點(diǎn)ADC等新型XDC藥物風(fēng)起泉涌;且從腫瘤治療領(lǐng)域擴(kuò)疆拓土到自身免疫疾病等其他創(chuàng)新領(lǐng)域。
ADC藥物結(jié)構(gòu)復(fù)雜多樣化,體內(nèi)作用及代謝過程復(fù)雜性,這些為CMC研究、臨床前研究等帶來多重挑戰(zhàn)。不同的腫瘤微環(huán)境不同,靶蛋白不同,對(duì)于ADC藥物來說選用何種抗體、有效載荷、連接子、連接方式等都需要進(jìn)行特異性考慮。泛偶聯(lián)時(shí)代,每一款偶聯(lián)藥物,都應(yīng)該結(jié)合自身特點(diǎn)找準(zhǔn)定位,形成差異化競爭策略,走創(chuàng)新化的研發(fā)之路,滿足未被滿足的臨床需求。
抗體藥物偶聯(lián)物 (ADC) 是一種將高選擇性的抗體 (Antibody) 和強(qiáng)細(xì)胞毒性的有效載荷 (Payload) 通過連接子 (Linker) 偶聯(lián)而獲得的藥物。ADC經(jīng)典有效載荷通常是有效的抗有絲分裂細(xì)胞毒素或DNA烷化劑或具有其他細(xì)胞殺傷機(jī)制的試劑。ADC結(jié)合了單抗對(duì)腫瘤細(xì)胞的靶向性以及細(xì)胞毒性藥物的強(qiáng)大腫瘤殺傷力,且克服了單抗的細(xì)胞毒性弱和細(xì)胞毒性藥物系統(tǒng)毒性大的問題,具有1+1>2的治療優(yōu)勢。
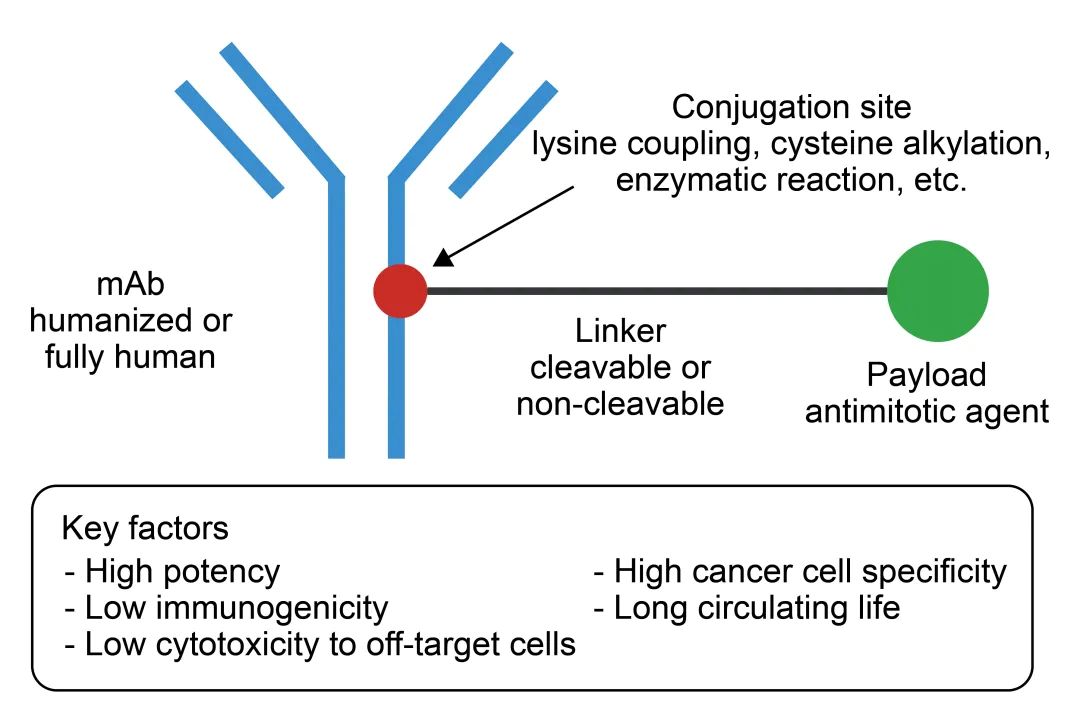
ADC藥物結(jié)構(gòu)[1]
目前,許多ADC藥物已顯示出治療難治性腫瘤的活性,從而獲得了眾多不同適應(yīng)癥的批準(zhǔn)。然而,它們的更廣泛應(yīng)用受到各種挑戰(zhàn)的限制,包括毒性、預(yù)測性生物標(biāo)志物等等。ADC的功效取決于抗體特異性、連接子特異性和有效載荷特異性等多種因素,每種因素都影響著ADC與腫瘤各組分及腫瘤微環(huán)境 (TME) 之間復(fù)雜的相互作用。
鑒于有效載荷、連接子和偶聯(lián)方法的改進(jìn),ADC的開發(fā)在過去十幾年中取得了顯著進(jìn)展。特別是連接子的設(shè)計(jì)對(duì)調(diào)節(jié)ADC在體循環(huán)中的穩(wěn)定性和腫瘤中的有效載荷釋放效率方面起著關(guān)鍵作用,從而影響ADC的藥代動(dòng)力學(xué) (PK)、藥效和毒性等特征。
以靶向CD33的吉妥珠單抗 (Mylotarg?) 為代表,使用鼠源或嵌合人源化抗體,連接子不穩(wěn)定,小分子毒素毒性低且是隨機(jī)偶聯(lián),因而有效性不高,不足以殺死腫瘤細(xì)胞;毒素在血漿中提前釋放而導(dǎo)致嚴(yán)重的毒性反應(yīng),所以毒副作用較大。
以靶向CD30的維布妥昔單抗 (Adcetris?) 和靶向HER2 的恩美曲妥珠單抗 (Trastuzumab emtansine;T-DM1) 為代表,使用人鼠嵌合抗體、人源化單抗,采用毒性更高的細(xì)胞毒素和更穩(wěn)定的連接子,抗體的靶向性更好;但藥物/抗體比率 (DAR) 不均一,降低了療效;且隨機(jī)偶聯(lián)造成的脫靶毒性仍繼續(xù)存在。
以靶向HER2的德曲妥珠單抗 (Trastuzumab deruxtecan;DS-8201) 為代表,使用完全人源化的抗體、高毒性小分子毒素及定點(diǎn)偶聯(lián)技術(shù),將不可裂解連接子升級(jí)為可裂解連接子,藥物抗體比高達(dá)8,具有更好療效,但毒副作用仍存在。在多個(gè)臨床試驗(yàn)中發(fā)現(xiàn)了DS-8201有引發(fā)間質(zhì)性肺炎的概率,因此被FDA黑框警告。2019年,DS8201獲得FDA批準(zhǔn)用于HER2陽性乳腺癌的后線治療。第三代ADC藥物 DS-8201給腫瘤治療領(lǐng)域,尤其是靶向HER2低表達(dá)/HER2突變的腫瘤治療帶來了革命性的突破。
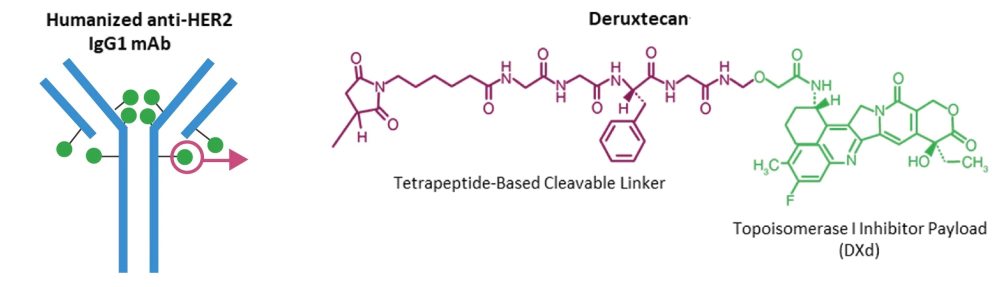
Trastuzumab deruxtecan (DS-8201) 結(jié)構(gòu)[2]
要解決前面3代ADC的耐藥問題,就需要新的ADC藥物具備更大的治療窗。比如從抗體、有效載荷、連接子、偶聯(lián)技術(shù)等多方面進(jìn)行優(yōu)化。具備更多新技術(shù)加持的第四代ADC,再結(jié)合適當(dāng)?shù)霓D(zhuǎn)化醫(yī)學(xué)研究勢必會(huì)為腫瘤研究帶來更多的突破。
目前全球共有15款A(yù)DC藥物獲批上市,用于治療血液惡性腫瘤和實(shí)體瘤。此外,超過400種ADC藥物正處于不同的研發(fā)階段。
較為熱門的靶點(diǎn)包括:CD22、HER2、EGFR、Trop-2、BCMA、Nectin-4等。
以腫瘤為主,其次是自身免疫性疾病、細(xì)菌感染、濕性年齡相關(guān)性黃斑變性等。腫瘤主要為乳腺癌、肺癌、胃癌等。
目前絕大多數(shù)的研發(fā)項(xiàng)目均處于早期階段。主要集中在臨床前期和臨床Ⅰ期。
ADC的作用機(jī)制復(fù)雜,通常需要藥物內(nèi)化,然后進(jìn)行細(xì)胞內(nèi)處理和有效載荷釋放。
ADC作用的典型模型假設(shè)如下:抗體與目標(biāo)抗原的結(jié)合,隨后內(nèi)化,經(jīng)內(nèi)體運(yùn)輸進(jìn)入溶酶體,在溶酶體中ADC的連接子或抗體部分降解并釋放出有效載荷,有效載荷則進(jìn)一步發(fā)揮作用產(chǎn)生細(xì)胞毒性進(jìn)而殺死腫瘤細(xì)胞。但實(shí)際情況更為復(fù)雜,并且ADC之間存在明顯差異。
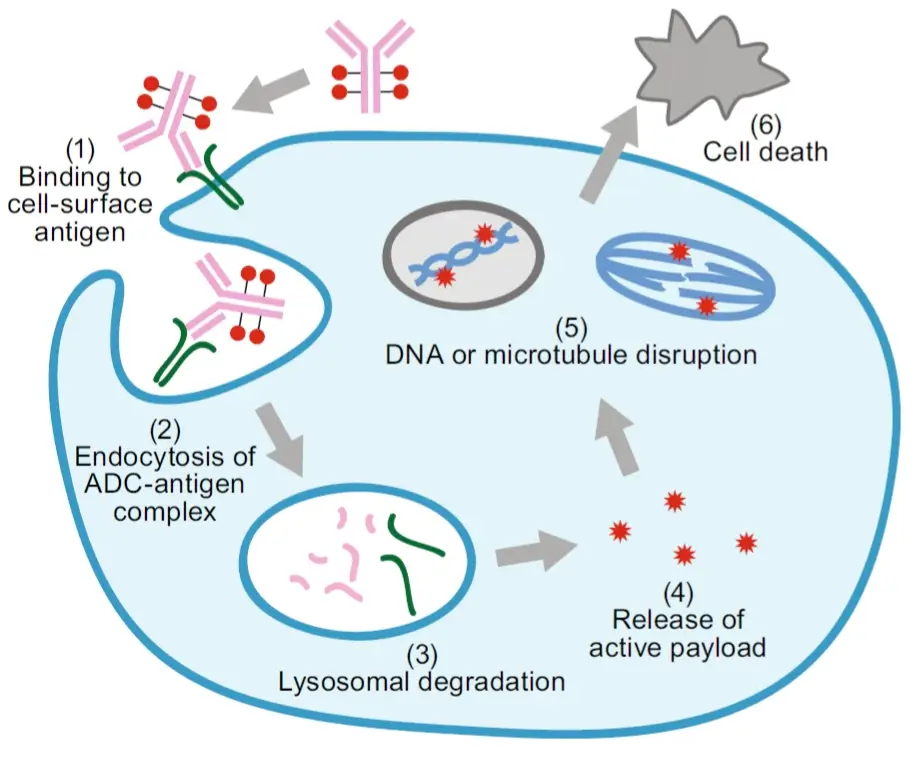
ADC藥物作用機(jī)制 [1]
靶抗原的選擇是ADC藥物設(shè)計(jì)的關(guān)鍵一環(huán)。需滿足:
1. 特異性,腫瘤細(xì)胞高表達(dá)、正常細(xì)胞低表達(dá)或不表達(dá);
2. 靶抗原需為腫瘤細(xì)胞表面抗原;
3. 高效誘導(dǎo)內(nèi)在化過程等。
理論上ADC藥物可在腫瘤細(xì)胞外釋放毒素,不經(jīng)過細(xì)胞內(nèi)在化,通過“旁觀者效應(yīng)”對(duì)腫瘤細(xì)胞造成殺傷。但實(shí)際上目前大部分ADC藥物療效的實(shí)現(xiàn)均是以內(nèi)在化后的藥物釋放為基礎(chǔ)。因此,ADC藥物中的抗體和腫瘤細(xì)胞表面抗原結(jié)合后,ADC-抗原復(fù)合物需能有效誘導(dǎo)內(nèi)在化過程,進(jìn)入腫瘤細(xì)胞內(nèi),并通過適當(dāng)?shù)募?xì)胞內(nèi)轉(zhuǎn)運(yùn)和降解過程,實(shí)現(xiàn)小分子藥物的有效釋放。
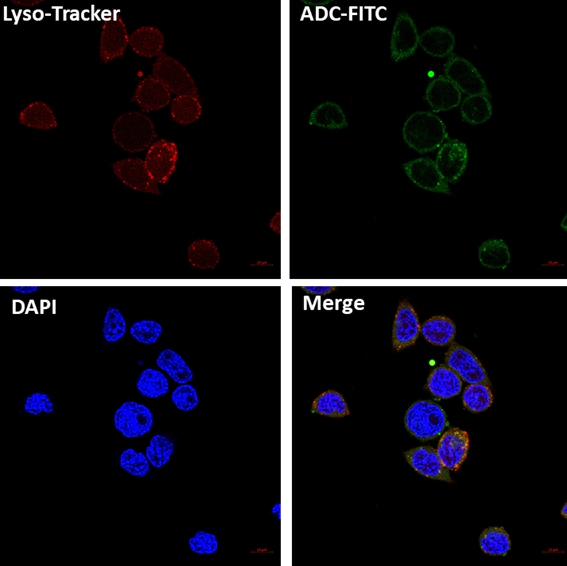
通過細(xì)胞免疫熒光Confocal檢測ADC內(nèi)在化
基于抗體的藥物出現(xiàn),使得腫瘤、自身免疫性疾病、心血管疾病、良性血液病和骨骼疾病等多種疾病的治療取得了實(shí)質(zhì)性進(jìn)展。抗體片段和雙特異性抗體為創(chuàng)新療法提供了很有潛力的治療前景。抗體需要滿足高特異性、強(qiáng)靶點(diǎn)結(jié)合能力、低免疫原性、低交叉反應(yīng)活性,以達(dá)到腫瘤細(xì)胞對(duì)ADC藥物更高效的攝入和ADC藥物在血清中更長的半衰期。
免疫球蛋白G (IgG) 是ADC中使用的主要抗體骨架。所以,臨床和臨床前研究的ADC藥物通常選擇IgG作為靶向目的抗原的抗體。IgGs可分為四個(gè)亞型:IgG1、IgG2、IgG3和IgG4 。其中,IgG1由于能夠較好地平衡長血液半衰期和強(qiáng)免疫激活的關(guān)系,并且有著較高的自然豐度,是被研究和采用最多的ADC抗體。IgG4由于較低的免疫激活效應(yīng)也經(jīng)常被采用在一些對(duì)免疫原性反應(yīng)要求較高的ADC藥物設(shè)計(jì)中。
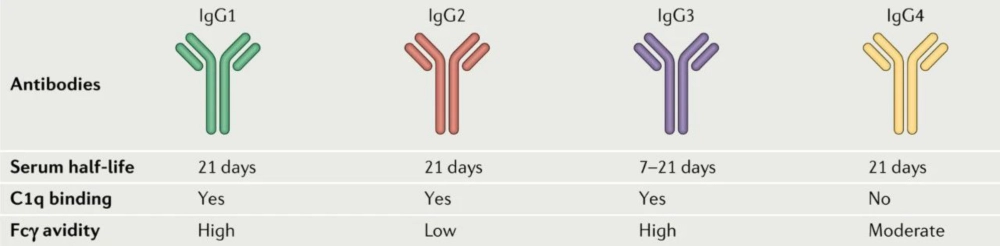
不同IgG對(duì)比[3]
早期的ADC藥物設(shè)計(jì)旨在攜帶具有已知抗腫瘤活性的傳統(tǒng)化療藥物,例如甲氨蝶呤、多柔比星或長春花生物堿。然而,這些ADC并不比它們的小分子細(xì)胞毒性藥物更有效,有時(shí)需要極高的活性劑量,這反而增加了毒性。
數(shù)據(jù)表明,只有很小一部分腫瘤靶向的抗體的給藥劑量到達(dá)腫瘤組織,這意味著需要具有更大細(xì)胞毒性的有效載荷才能實(shí)現(xiàn)治療效果。對(duì)攜帶高效化療藥物(如澳瑞他汀類、卡奇霉素類、美登素類和喜樹堿類似物)的ADC進(jìn)行實(shí)驗(yàn),這些高效化療藥物在亞納摩爾濃度下可能具有細(xì)胞毒性。
澳瑞他汀包括單甲基澳瑞他汀 E (MMAE) 和單甲基澳瑞他汀 F (MMAF),是微管去穩(wěn)定劑。卡奇霉素,如奧佐米星,是一種DNA結(jié)合化合物,可導(dǎo)致雙鏈DNA斷裂。美登素類化合物,例如DM1,來源于美登素,并與微管蛋白結(jié)合,從而破壞微管動(dòng)態(tài)不穩(wěn)定性。喜樹堿類似物,包括依喜替康衍生物DXd和伊立替康代謝物SN-38,可抑制拓?fù)洚悩?gòu)酶 I (TOPO1),導(dǎo)致DNA斷裂。
選擇小分子藥物時(shí),首先要求小分子藥物IC50值低至納摩爾級(jí)別乃至皮摩爾級(jí)別。除需要較低的IC50值以外,通常還需要小分子藥物包括以下幾點(diǎn):
1. 在與抗體偶聯(lián)后不易引起ADC藥物發(fā)生聚集,以保證在體內(nèi)擁有較長的循環(huán)時(shí)間;
2. 本身以及形成后的ADC藥物需具有較低的免疫原性;
3. 在水溶液(血液)中足夠穩(wěn)定且具有合適的反應(yīng)位點(diǎn)通過連接子與抗體偶聯(lián),偶聯(lián)后仍然能夠保證其生物活性;
4. 可以通過相對(duì)具有經(jīng)濟(jì)效益的過程合成。
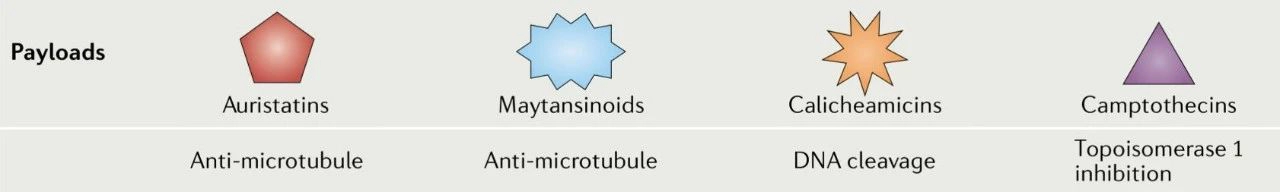
ADC藥物的有效載荷[3]
自ADC開發(fā)早期以來,連接子技術(shù)取得了長足的進(jìn)步。理想的連接子應(yīng)在血液循環(huán)中十分穩(wěn)定,以避免小分子毒素提前釋放損傷正常的組織或細(xì)胞。同時(shí),在腫瘤細(xì)胞內(nèi)需能快速且有效地釋放有效載荷。
連接子的設(shè)計(jì)具有雙重目的:
1. 確保當(dāng)藥物在血漿中循環(huán)時(shí),細(xì)胞毒性有效載荷仍然牢固地附著在抗體部分上。在血漿中不穩(wěn)定的連接子可能會(huì)過早釋放有效載荷,導(dǎo)致過度的全身毒性和腫瘤部位抗原接合時(shí)有效載荷的傳遞減少。考慮到許多ADC攜帶具有毒性特征的高效細(xì)胞毒性有效載荷,這使得它們不適合全身給藥,因此這個(gè)問題尤其重要。
2. 確保有效載荷在腫瘤內(nèi)有效釋放,尤其是在癌細(xì)胞內(nèi)。不能正確傳遞其有效載荷的ADC則失去了相對(duì)于裸抗和傳統(tǒng)細(xì)胞毒性藥物的獨(dú)特優(yōu)勢。
連接子主要有兩種類型:可裂解型 (cleavable) 和不可裂解型 (non-cleavable)。
連接子需要考慮穩(wěn)定性和釋放效率的平衡。不可裂解連接子更具穩(wěn)定性優(yōu)勢,可裂解連接子釋放效率更高。可裂解型的連接子又可以分為:酸可裂解的、可還原的和蛋白酶可裂解的。
不可裂解連接子的實(shí)例包括:硫醚連接子(如在T-DM1中使用)和基于馬來酰亞胺的連接子(如在 Belantamab mafodotin 中使用)。在實(shí)際使用中,可裂解連接子在循環(huán)中表現(xiàn)出不同程度的穩(wěn)定性,并且會(huì)隨著時(shí)間在血漿中降解。相比之下,不可裂解的連接子在血漿中往往更穩(wěn)定,但依賴于整個(gè)抗體-連接子構(gòu)建體的溶酶體降解來釋放其有效載荷,通常導(dǎo)致有效載荷上帶電氨基酸的保留,這可能會(huì)影響其作用或細(xì)胞通透性。
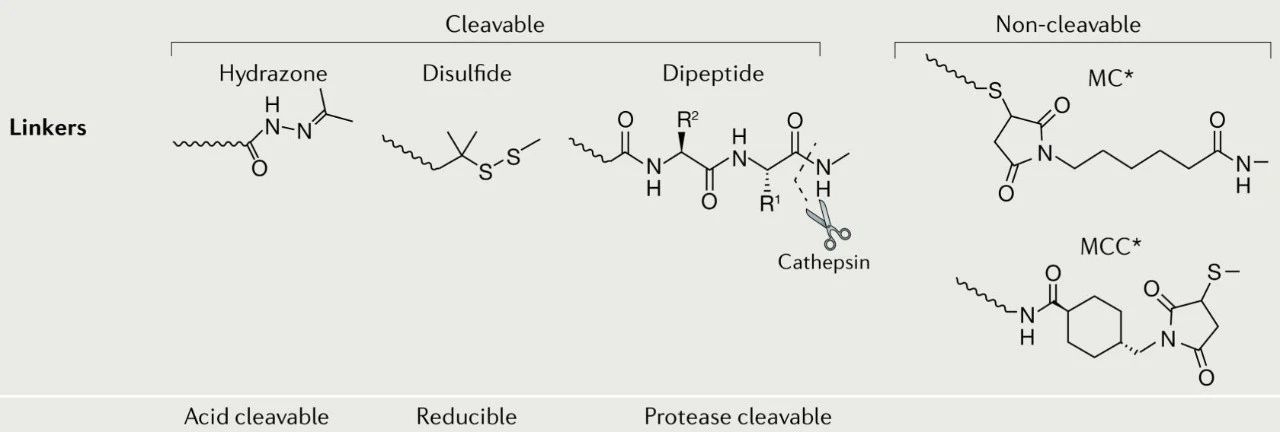
ADC藥物的連接子[3]
偶聯(lián)技術(shù)通過連接子將抗體和有效載荷連接到一起,涉及化學(xué)反應(yīng)、抗體修飾與改造等相關(guān)技術(shù)。
ADC藥物所采用的偶聯(lián)技術(shù)與其最終的藥物抗體比率(Drug to Antibody Ratio;DAR)密切相關(guān),而DAR的數(shù)值及其分布會(huì)顯著影響ADC藥物性質(zhì)。
DAR是連接到每個(gè)mAb的有效載荷部分的平均數(shù)量,可通過HPLC-MS等測試方法獲得。DAR對(duì)藥物藥理學(xué)和活性有影響,DAR值對(duì)ADC藥物研發(fā)后期階段是必不可少的。ADC藥物在體內(nèi)循環(huán)過程中被腫瘤細(xì)胞攝入數(shù)量有限,因此通常較高的DAR有利于提高效力。然而ADC藥物中采用的小分子藥物有著較強(qiáng)的疏水性,DAR值過高時(shí)會(huì)引起ADC藥物聚集,導(dǎo)致在體內(nèi)循環(huán)半衰期減少以及毒副作用提高,這就導(dǎo)致過高的DAR不可取,臨床前和臨床用ADC一般DAR值在2-8范圍。
為獲得更高DAR以及均一性的ADC藥物,可通過基因工程對(duì)抗體進(jìn)行改造使抗體具有數(shù)量固定并且高效的反應(yīng)位點(diǎn)用于偶聯(lián)小分子藥物。

藥物抗體比 (DAR) [4]
ADC生產(chǎn)制備流程復(fù)雜,整體工藝與質(zhì)控體系研發(fā)能力非常關(guān)鍵。ADC藥物生產(chǎn)制造流程包括抗體生產(chǎn)、細(xì)胞毒藥物/連接子生產(chǎn)、ADC原料藥和制劑生產(chǎn)三大模塊,均須進(jìn)行工藝開發(fā)與驗(yàn)證,還須對(duì)所用工程細(xì)胞、起始原料及試劑制定合理的質(zhì)量控制要求。
偶聯(lián)生產(chǎn)用中間體的質(zhì)量控制較為靈活,考驗(yàn)整體工藝與質(zhì)控體系研發(fā)能力。由于抗體和細(xì)胞毒素有著不同的生物物理化學(xué)性質(zhì),例如分子大小以及疏水性等差異,ADC藥物生產(chǎn)面臨著巨大的挑戰(zhàn)。工藝表征研究對(duì)后續(xù)工藝性能確認(rèn)批次具有非常重要的導(dǎo)意義。
ADC藥物的CMC研究主要包括4部分:1. 抗體;2. 載荷-連接子中間體;3. ADC原料藥;4. 制劑部分。
同時(shí),還需要引入一些特殊的質(zhì)量控制指標(biāo)。如藥物與抗體的比率,載荷與抗體的連接位點(diǎn)以及ADC藥物中的藥物負(fù)載分布等。此外,ADC中游離的載荷和抗體需要進(jìn)行量化控制,載荷連接抗體后對(duì)抗體和靶點(diǎn)結(jié)合效力的影響以及ADC在人體血漿中的穩(wěn)定性也需要進(jìn)行研究。
當(dāng)下階段,ADC對(duì)臨床腫瘤的治療格局已經(jīng)產(chǎn)生了深遠(yuǎn)影響,在追趕研發(fā)浪潮的同時(shí),也需審慎關(guān)注研發(fā)技術(shù)難關(guān)。由于ADC的復(fù)雜性和多樣性,以及生物樣本中釋放的細(xì)胞毒藥物含量較低等原因,對(duì)藥代動(dòng)力學(xué) (PK) 和藥效學(xué) (PD) 表征提出了獨(dú)特的挑戰(zhàn)。此外,在安全性評(píng)價(jià)中生物分析方法的選擇和檢測的準(zhǔn)確性也是考量要素。
近年來,ADC藥物領(lǐng)域發(fā)展很快,越來越多ADC藥物獲批激發(fā)了醫(yī)藥人對(duì)ADC的研發(fā)熱情。無論是欣欣向榮的Biotech們還是根深葉茂的Biopharma們,都需要找到自己在該賽道的最佳位置,關(guān)注自身優(yōu)勢,差異化發(fā)展核心競爭力,推動(dòng)更多更高效更低副作用的ADC藥物獲批上市。
隨著抗體的發(fā)展、連接子不斷的優(yōu)化、高活性有效的發(fā)掘和偶聯(lián)技術(shù)的不斷完善,高效低毒的ADC藥物將會(huì)不斷涌現(xiàn)。如果能夠更好地理解和利用ADC與腫瘤相互作用的微妙之處,則ADC技術(shù)的真正潛力會(huì)更好地發(fā)揮和更廣泛地應(yīng)用,最終可能對(duì)腫瘤患者的治療產(chǎn)生變革性影響。
[1] Kyoji Tsuchikama, et al. Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell. 2018Jan;9(1):33-46.
[2] Ibrahim Azar, et al. Spotlight on Trastuzumab Deruxtecan (DS-8201, T-DXd) for HER2 Mutation Positive Non-Small Cell Lung Cancer. Lung Cancer (Auckl). 2021 Oct 7; 12:103-114. doi: 10.2147/LCTT.S307324.
[3] Joshua Z Drago, et al. Unlocking the potential of antibody-drug conjugates for cancer therapy. Nat Rev Clin Oncol. 2021 Jun;18(6):327-344.
[4] Dan Lu, et al. Semi-mechanistic Multiple-Analyte Pharmacokinetic Model for an Antibody-Drug-Conjugate in Cynomolgus Monkeys. Pharm Res. 2015Jun;32(6):1907-19.
美迪西在ADC的臨床前一體化研究方案制定中與客戶深入交流,科研骨干將每一個(gè)案例的特點(diǎn)與多年實(shí)戰(zhàn)經(jīng)驗(yàn)和技術(shù)積累相結(jié)合,謹(jǐn)慎地將優(yōu)質(zhì)實(shí)驗(yàn)方案與結(jié)果提交到客戶手上。美迪西可以為客戶提供ADC Payloads合成、ADC藥物偶聯(lián)、ADC藥效學(xué)評(píng)價(jià)、ADC藥代動(dòng)力學(xué)評(píng)價(jià)和ADC安全性評(píng)價(jià)等服務(wù)。截至目前,美迪西承接的IND申報(bào)類生物藥大項(xiàng)目已經(jīng)100多項(xiàng),包括單抗、雙抗、多抗、ADC、病毒疫苗和融合蛋白等。
截至2024年8月,美迪西已成功助力28個(gè)ADC藥物獲批臨床,并有20+ADC項(xiàng)目在研。
 相關(guān)新聞
相關(guān)新聞時(shí)間:2020年12月09-10日
地點(diǎn):上海浦東綠地鉑驪酒店
時(shí)間:2018年10月25日 14:00-16:00
地點(diǎn):大興區(qū)北京亦莊生物醫(yī)藥園咖啡廳