



業(yè)務(wù)咨詢
中國:
Email: marketing@medicilon.com.cn
業(yè)務(wù)咨詢專線:400-780-8018
(僅限服務(wù)咨詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com





生物分析能力是藥物臨床前研究和臨床研究的基石能力,是美迪西這類CRO機(jī)構(gòu)助力國內(nèi)外客戶順利推進(jìn)藥物開發(fā)進(jìn)程的技術(shù)基礎(chǔ)。生物分析雖然是一門技術(shù)性很強(qiáng)實(shí)踐性很強(qiáng)的工作領(lǐng)域,如果僅就分析看分析,僅就技術(shù)本身思考技術(shù)對于研發(fā)過程中遇到各種情況和問題的解決可能會(huì)帶來思路上的局限性。做好生物分析工作,離不開技術(shù)實(shí)踐,更離不開相關(guān)基礎(chǔ)理論知識(shí)的支撐,實(shí)踐反饋理論,理論指導(dǎo)實(shí)踐,一些基礎(chǔ)理論不僅具指導(dǎo)價(jià)值,有時(shí)也具啟發(fā)性,有利于廣拓視角。美迪西美研小編團(tuán)隊(duì)推出生物分析系列專欄,邀請本領(lǐng)域的資深專業(yè)人員從不同的視角筆談生物分析相關(guān)的話題。
目前熱門和已上市的核酸藥物主要包括mRNA和寡核苷酸兩大類,mRNA既可以作為為疫苗,又可以作為治療性藥物,需要差異性地考慮其PK/PD的評估策略;寡核苷酸目前成藥的主要是ASO和siRNA,這些核酸藥物又兼顧了小分子與大分子藥物的一些PK/PD特征。
基因治療目前有多個(gè)不同層面的理解,狹義基因治療一般定義是使用正常的基因替代、糾正異常的基因,或者將異常的基因敲除以達(dá)到治療疾病的目的。基于中心法則上去理解,狹義的基因治療也可以從另一個(gè)層面定義為通過糾正中心法則過程中出現(xiàn)的問題,如基因突變導(dǎo)致的功能性蛋白質(zhì)缺失或異常等(參見圖1和圖2),以達(dá)到治療疾病的目的。在廣義的基因治療概念下,溶瘤病毒、細(xì)胞治療,核酸類藥物均可被納入基因治療的范疇,但并不是所有的核酸藥物都屬于基因治療范疇,如mRNA藥物僅有一部分可以被納入基因治療的范疇。
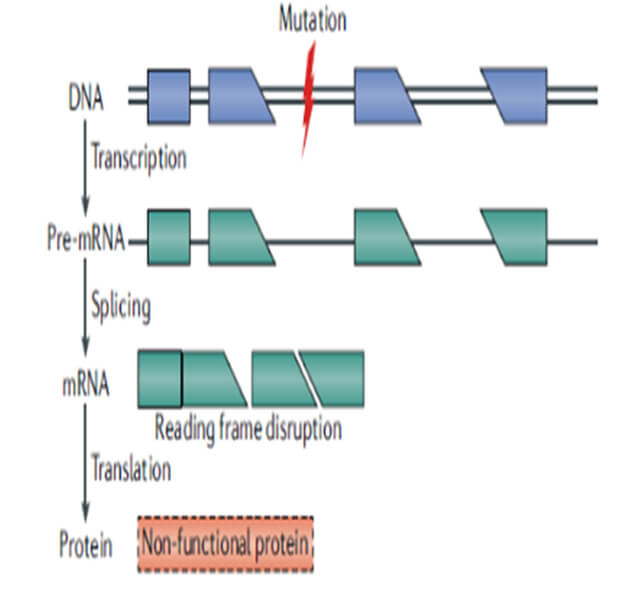
圖1. 基因突變影響開放閱讀框而不能形成有功能的蛋白
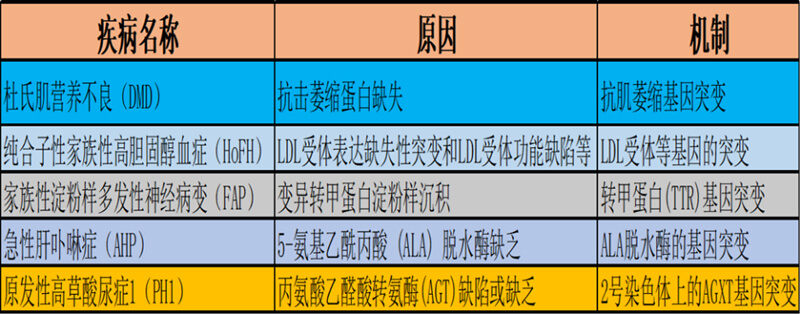
圖2. 部分寡核苷酸藥物針對的遺傳病
目前的基因治療領(lǐng)域有兩個(gè)離不開核酸的有趣的現(xiàn)象,即RNA干擾和CRISPR基因編輯。RNA干擾和CRISPR基因編輯也都是一種生物體內(nèi)抗病毒感染的免疫機(jī)制,是在核酸水平上的免疫,有人稱其為基因免疫或基因組免疫。而經(jīng)典的免疫學(xué)里涉及的免疫系統(tǒng)中的免疫分子包括抗體、補(bǔ)體、配體、受體和細(xì)胞因子等成分一般都是氨基酸為基本組成單元的分子,沒有核苷酸作為基本組分的分子的直接參與。
未來是否有更多類似于RNA干擾和基因編輯的核酸層面的機(jī)制被發(fā)掘而可能會(huì)進(jìn)一步地豐富我們對免疫學(xué)的認(rèn)知,并且在基因組免疫領(lǐng)域的概念會(huì)越來越豐富、發(fā)展,甚至逐步成為免疫學(xué)的一大分支,或許也能作為我們的一種額外期待。
核酸藥物經(jīng)過幾十年的積累,在近幾年達(dá)到了爆發(fā)期。目前國內(nèi)外上市的基因治療藥物主要是mRNA疫苗和主要針對遺傳病的寡核苷酸類藥物(如圖3)。所以本文主要將核酸類藥物分為mRNA藥物和寡核苷酸藥物兩類,分別進(jìn)行簡要闡述。
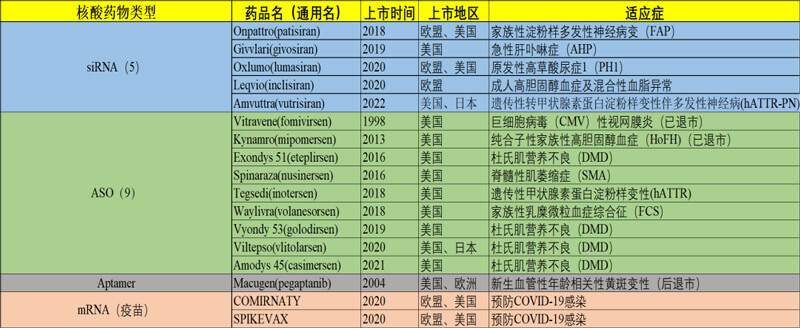
圖3. 國際上市的主要核酸類藥物(截至2023年3月,暫未列國內(nèi)廠家產(chǎn)品)
mRNA藥物的優(yōu)勢包括:
(1)可以導(dǎo)入細(xì)胞,在體內(nèi)直接表達(dá)目的蛋白;
(2)mRNA的降解通過細(xì)胞正常代謝完成,無明顯的毒性;
(3)既能刺激體液免疫,又能刺激細(xì)胞免疫應(yīng)答;
(4)既可以開發(fā)為疫苗,又可以開發(fā)為治療性藥物等。
mRNA藥物的缺點(diǎn)包括:
(1)不穩(wěn)定,易被核酸酶等降解;
(2)制備工藝復(fù)雜;
(3)使用純生物藥的生產(chǎn)路徑;
(4)需要超低溫運(yùn)輸?shù)取?/p>
制定mRNA產(chǎn)品臨床前藥代動(dòng)力學(xué)藥效學(xué)(PK/PD)考察分析策略的前提是判斷其屬于疫苗還是治療性藥物。兩者存在以下不同:
(1)編碼蛋白的性質(zhì)不同,mRNA疫苗編碼病毒或腫瘤抗原蛋白,一般少量蛋白表達(dá)就可以發(fā)揮作用, 治療性藥物則通常需要更高的蛋白表達(dá)量;
(2)遞送要求不同,疫苗無需組織特異性,mRNA治療性藥物則期望遞送到特定的組織后進(jìn)行翻譯表達(dá);
(3)給藥方式不同,目前上市和在研mRNA疫苗多為肌肉注射,治療性藥物則根據(jù)具體治療性質(zhì)常采用系統(tǒng)給藥,甚至靶組織局部給藥;
(4)遵循的法規(guī)不同,mRNA疫苗需要遵循疫苗的指導(dǎo)原則,免疫原性屬于其PD指標(biāo),而治療性藥物則不同的遵循,免疫原性也非是研發(fā)者所期望。
mRNA疫苗可以在細(xì)胞內(nèi)表達(dá)病毒或細(xì)菌蛋白,刺激機(jī)體產(chǎn)生免疫保護(hù)性抗體,或者表達(dá)腫瘤新生抗原,從而制備個(gè)性化腫瘤疫苗。部分mRNA疫苗如針對基因突變產(chǎn)生的腫瘤新生抗原開發(fā)的疫苗,可以被認(rèn)為是基因治療產(chǎn)品。但另一部分mRNA疫苗表達(dá)病毒抗原如新冠疫苗可直接表達(dá)SARS-CoV-2的刺突蛋白或刺突蛋白的RBD結(jié)構(gòu)域,誘導(dǎo)機(jī)體產(chǎn)生免疫應(yīng)答,一般不認(rèn)為是基因治療產(chǎn)品,故如前所述只是部分mRNA產(chǎn)品屬于基因治療范疇。
mRNA疫苗臨床前PK/PD考察分析的要素主要有:
(1)預(yù)防用生物制品的指導(dǎo)原則中指出疫苗通常不需要進(jìn)行常規(guī)的藥代動(dòng)力學(xué)研究,但某些特殊類型疫苗應(yīng)需要進(jìn)行生物分布的研究;
(2)非臨床研究中,需要研究mRNA和脂質(zhì)納米顆粒(LNPs)或其它脂質(zhì)成分是否在接種疫苗的組織中分布,它們分布在哪些組織中,以及它們的持續(xù)時(shí)間。
(3)作為疫苗一般不用分析表達(dá)產(chǎn)物,但其表達(dá)產(chǎn)物的免疫原性相當(dāng)于其重要的藥效指標(biāo)。
基于mRNA疫苗的機(jī)制和效果,對于免疫原性方面,既要考慮結(jié)合抗體又要考慮中和抗體,不僅考慮B細(xì)胞免疫還要考慮細(xì)胞免疫(參見圖4),與治療性藥物相比,mRNA疫苗的免疫原性很強(qiáng),一般不需要使用高成本高靈敏的檢測技術(shù)進(jìn)行結(jié)合抗體的檢測。
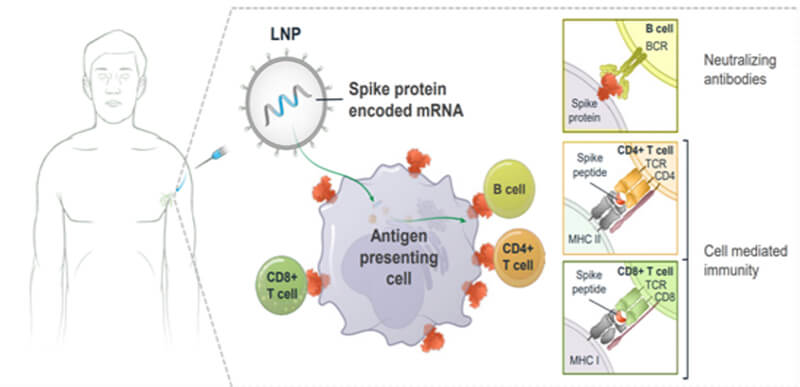
圖4. mRNA疫苗作用機(jī)制示意圖
mRNA治療性藥物有如下效用方式:
(1)抗體效用,即直接表達(dá)用于治療當(dāng)前和新發(fā)疾病的預(yù)防性或治療性抗體;
(2)蛋白替代療法,即直接表達(dá)一種人類蛋白來解決遺傳疾病,如血友病;
(3)基因編輯/堿基編輯,即表達(dá)基因組編輯蛋白或堿基編輯蛋白來修飾人類基因表達(dá)。
mRNA治療性藥物通過編碼功能性治療蛋白,由所表達(dá)的蛋白產(chǎn)物發(fā)揮治療作用。該類藥物的臨床前PK/PD分析需要有以下兩個(gè)考慮點(diǎn):
(1)PD的持續(xù)與mRNA產(chǎn)物的表達(dá)量和表達(dá)時(shí)相相關(guān),即存在一定的量效關(guān)系;
(2)藥物的PK研究如吸收和分布的研究有利于評價(jià)量效關(guān)系。
mRNA治療性藥物的臨床前PK/PD分析需要考查的要素有:
(1)PK分析:即mRNA濃度隨時(shí)間變化的分析;
(2)將表達(dá)產(chǎn)物,即目標(biāo)蛋白的表達(dá)量與分布作為PD指標(biāo)進(jìn)行分析;
(3)脂質(zhì)體成分的藥代分布分析,尤其是新型脂質(zhì)輔料。
此外,PK/PD與免疫原性間通常具有關(guān)聯(lián)性,對于mRNA治療性藥物需要同時(shí)分析mRNA本身和脂質(zhì)體成分的免疫原性影響,聚乙二醇化LNP產(chǎn)生抗體已有報(bào)道,抗PEG抗體已被廣泛研究和報(bào)道,筆者所在機(jī)構(gòu)也分析出LNP的PEG成分可見一定程度的免疫原性,筆者所在機(jī)構(gòu)表達(dá)IgG1亞型抗體的治療性mRNA產(chǎn)品在食蟹猴靜脈給藥的PK/PD試驗(yàn)例中全面兼顧了本文所列要點(diǎn)。
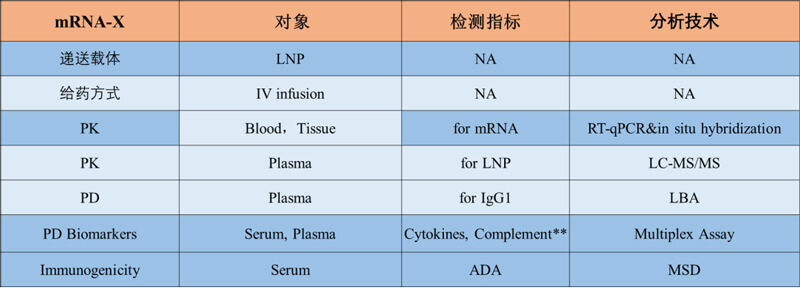
圖5. mRNA治療性藥物的PK/PD研究設(shè)計(jì)實(shí)施例
目前寡核苷酸類產(chǎn)品成藥上市的主要為反義寡核苷酸(ASO)與siRNA,而miRNA研發(fā)進(jìn)入臨床試驗(yàn)的極少,所以本部分的分析僅以ASO與siRNA藥物為代表。ASO和siRNA的主要區(qū)別在于,前者是單鏈,后者是雙鏈RNA。而雙鏈的siRNA作用機(jī)制與RISC形成有關(guān),RISC可反復(fù)作用靶標(biāo)mRNA; siRNA被釋放的正義鏈或被降解,也可作為引物,在RNA依賴的RNA聚合酶的催化下以靶mRNA為模板擴(kuò)增得到dsRNA,dsRNA又可被Dicer降解成siRNA,進(jìn)入RNAi循環(huán),所以藥物效果更持久甚至有級聯(lián)放大效果。
寡核苷酸類藥物的PK特征包括:
(1)靜脈給藥和其它途徑給藥,藥物進(jìn)入靶部位的方式不同,導(dǎo)致體內(nèi)的PK過程也不一樣;
(2)裸siRNA不穩(wěn)定,易被血液和組織中核酸酶降解;
(3)容易在肝臟和腎臟中聚集,并經(jīng)腎臟排泄;
(4)非腦內(nèi)給藥時(shí),不易過腦;
(5)兩條鏈被修飾的方式不一樣,導(dǎo)致兩條鏈的PK參數(shù)比如峰濃度和暴露量不一致;
(6)在給藥局部存留時(shí)間長;
(7)血液清除速度要快于組織;
(8)目前的藥物基本都為體外合成的RNA分子,可被免疫系統(tǒng)吞噬,有些還會(huì)激活天然免疫,如toll樣受體參與引發(fā)免疫反應(yīng),比如干擾素(IFN-α、IFN-β)、細(xì)胞因子(TNF-α、IL-6)產(chǎn)生等。寡核苷酸藥物主要經(jīng)核酸內(nèi)或外切酶代謝為短核苷酸碎片,和蛋白類藥物被蛋白酶切割降解為氨基酸類似,所以寡核苷酸藥物與傳統(tǒng)大分子藥物的代謝上有雷同之處,但許多寡核苷酸現(xiàn)實(shí)又多見修飾,其代謝產(chǎn)物分析仍需周全考慮;另其分子量是遠(yuǎn)大于小分子和一些多肽,分子量較大,需要考慮免疫原性潛在的對其PK/PD特征的影響。
寡核苷酸類藥物PK/PD考察分析的策略要點(diǎn)主要包括:
(1)按照小分子藥物PK研究思路設(shè)計(jì)相關(guān)研究內(nèi)容;
(2)兼顧其大分子藥物的部分特征,考慮免疫原性的影響,如抗藥物抗體(ADA)的分析,考慮代謝清除緩慢的特點(diǎn);
(3)對于siRNA,分析反義鏈和有義鏈所表征的PK行為是否有差異;
(4)必要時(shí),注意考察制劑輔料的PK特點(diǎn);
(5)設(shè)置相應(yīng)PD指標(biāo),如新功能蛋白的水平變化;
(6)適當(dāng)設(shè)置細(xì)胞因子、補(bǔ)體等PD生物標(biāo)志物指標(biāo),針對輔料如PEG的抗體檢測;
(7)利用合適平臺(tái)技術(shù)開發(fā)滿足實(shí)際靈敏度需求且穩(wěn)定的PK生物分析方法是一大挑戰(zhàn)。
分析寡核苷酸類藥物的PK/PD,離不開對其免疫原性的察。因?yàn)楣押塑账犷愃幬锸峭庠葱院怂岱肿樱肿恿科螅⑶沂菨撛诘娜蹩乖虬肟乖6庖咴援a(chǎn)生的主要原因可能與其產(chǎn)品因素、產(chǎn)品的藥理學(xué)因素以及給藥對象因素有關(guān),藥理學(xué)因素以及給藥對象因素具體機(jī)制與其它大分子的這兩方面因素大致相同,重點(diǎn)要考慮該類產(chǎn)品潛在引起免疫原性的本身的產(chǎn)品因素的不同如鏈型、堿基序列、堿基修飾、遞送載體成分、骨架修飾等。免疫原性的考察點(diǎn)的考慮基于siRNA等寡核苷酸的外源性性質(zhì),宿主系統(tǒng)會(huì)將其視為病原體,免疫系統(tǒng)可以通過細(xì)胞外和細(xì)胞內(nèi)不同的病原相關(guān)分子模式(PAMP)受體識(shí)別單鏈和雙鏈RNA與toll樣受體(TLRs)相互作用產(chǎn)生免疫應(yīng)答;以及TLRs刺激炎癥細(xì)胞因子和I型干擾素(IFN)的過量產(chǎn)生的免疫反應(yīng)。既要考慮體液免疫分析,又要考慮除寡核苷酸本身外的載體成分,甚至藥效機(jī)制發(fā)揮而生成的新的功能性蛋白成分的免疫原性。
核酸類藥物尤其是寡核苷酸類藥物,對生物分析帶來了巨大的挑戰(zhàn)。寡核苷酸類藥物的分子量不大不小、并存在藥物不穩(wěn)定、鏈型、修飾、弱免疫原或半抗原(導(dǎo)致特異陽性抗體的制備存在現(xiàn)實(shí)困難)等特征,這些都是構(gòu)成其分析挑戰(zhàn)的幾大因素。
目前主要有5種主流技術(shù)可以進(jìn)行核酸類藥物的PK分析,包括PCR技術(shù)、H-LBA、b-DNA、基于雜交的LC-UV/PL以及LC-MS/MS和LC-HRMS(圖6)。
其中,qPCR技術(shù)可以方便地檢測長度較長的核酸類藥物,靈敏度高,檢測范圍寬,但是需要復(fù)雜的樣品處理過程;ddPCR靈敏度更高,但耗材費(fèi)用高,成本高;對于較短的核酸檢測來說,雖然也可以通過莖環(huán)qPCR(Stem-Loop qPCR)的設(shè)計(jì)實(shí)現(xiàn),實(shí)施相對于較大的核酸要復(fù)雜。H-LBA方法的特異性高,靈敏度好,但是檢測效果非常依賴于探針的可靠性和設(shè)計(jì)技巧及反應(yīng)過程細(xì)節(jié)的優(yōu)化;b-DNA方法其實(shí)是H-LBA技術(shù)的拓展版,有很高的特異性、準(zhǔn)確性和更高的靈敏度,但檢測效果同樣高度依賴于特殊的探針設(shè)計(jì)及雜交反應(yīng)技術(shù)細(xì)節(jié);基于雜交的LC-UV/FL方法可以測定較長核酸類藥物,具備較好的特異性和準(zhǔn)確性,但是樣品處理復(fù)雜,靈敏度對熒光探針的準(zhǔn)確性高度依賴;LC-MS/MS和LC-HRMS方法也可以用于核酸類藥物的分析,選擇性好,可以區(qū)分全長和代謝產(chǎn)物,但是對非修飾的寡核苷酸類藥物檢測靈敏度和特異性相對較差,并且價(jià)格昂貴,不適宜測過長的核酸分子。其它的活體熒光成像,同位素示蹤、原位雜交、熒光原位雜交等分析技術(shù)可以作為補(bǔ)充手段,應(yīng)用于不同的目的和研究階段,但它們的精準(zhǔn)度差,不大適合作為后續(xù)的驗(yàn)證用方法。
圖6. 核酸類藥物生物分析的主流技術(shù)對比
近年來,核酸類藥物是近幾年來最熱門一大新藥研究方向。但核酸類藥物尤其是寡核苷酸類藥物與傳統(tǒng)小分子與大分子藥物成分存在顯著區(qū)別,給核酸類藥物的生物分析和PK/PD考察帶來了較大的技術(shù)挑戰(zhàn)。mRNA藥物作為疫苗和治療性藥物時(shí)考慮點(diǎn)不同,寡核苷酸類藥物同時(shí)兼顧了大小分子的一些PK/PD特征,需要根據(jù)具體的分子特征選擇PK/PD考察評估策略和分析的技術(shù)應(yīng)用策略。
[1]. Sun, H., et al., mRNA-Based Therapeutics in Cancer Treatment. Pharmaceutics, 2023. 15(2).
[2]. Takakusa, H., et al., Drug Metabolism and Pharmacokinetics of Antisense Oligonucleotide Therapeutics: Typical Profiles, Evaluation Approaches, and Points to Consider Compared with Small Molecule Drugs. Nucleic Acid Therapeutics, 2023.
[3]. Munter, R., et al., Studying how administration route and dose regulates antibody generation against LNPs for mRNA delivery with single-particle resolution. Mol Ther Methods Clin Dev, 2023. 29: p. 450-459.
[4]. Mu, R., et al., Bioanalytical Methods and Strategic Perspectives Addressing the Rising Complexity of Novel Bioconjugates and Delivery Routes for Biotherapeutics. BioDrugs, 2022. 36(2): p. 181-196.
[5]. Nonclinical Testing of Individualized Antisense Oligonucleotide Drug Products for Severely Debilitating or Life-Threatening Diseases; Draft Guidance for Sponsor-Investigators; Availability. 2021, Federal Information & News Dispatch, LLC: Washington. p. 22213.
[6]. Krienke, C., et al., A noninflammatory mRNA vaccine for treatment of experimental autoimmune encephalomyelitis. Science, 2021. 371(6525): p. 145-153.
[7]. Bioanalytical Methods and Strategic Perspectives Addressing the Rising Complexity of Novel Bioconjugates and Delivery Routes for Biotherapeutics.
[8]. Hirabayashi, Y., et al., Considerations of the Japanese Research Working Group for the ICH S6 & Related Issues Regarding Nonclinical Safety Assessments of Oligonucleotide Therapeutics: Comparison with Those of Biopharmaceuticals. Nucleic Acid Therapeutics, 2021. 31(2): p. 114-125.
[9]. 預(yù)防用生物制品臨床前安全性評價(jià)技術(shù)審評一般原則.NMPA, 2005.
[10]. 治療用生物制品非臨床安全性評價(jià)指導(dǎo)原則.NMPA, 2007.
[11]. 彭雙清,郝衛(wèi)東. 藥物安全性評價(jià)關(guān)鍵技術(shù)[M]. 北京: 軍事醫(yī)學(xué)科學(xué)出版社, 2013.
[12]. Evaluation of the quality, safety and efficacy of messenger RNA vaccines for the prevention of infectious diseases: regulatory considerations. WHO, 2021.