PROTAC, 全稱為Proteolysis-Targeting Chimeras(蛋白水解靶向嵌合體),是一種雜合雙功能小分子化合物,由靶蛋白配體、E3泛素連接酶配體和Linker三部分組成,兩個(gè)配體之間通過(guò) Linker 相連。
PROTAC賽道的企業(yè)簡(jiǎn)介
國(guó)外較早開發(fā) PROTAC 技術(shù)的公司有 Arvinas、C4 Therapeutics、Kymera Therapeutics 等。Arvinas 是 PROTAC 技術(shù)的先驅(qū),也是蛋白質(zhì)降解療法的全球領(lǐng)導(dǎo)者。Arvinas 公司開發(fā)的蛋白降解技術(shù)主要用于腫瘤和神經(jīng)系統(tǒng)類疾病的治療。目前進(jìn)展最快的 ARV-110 和 ARV-471 都處在II期臨床試驗(yàn),分別用于前列腺癌和乳腺癌的治療。
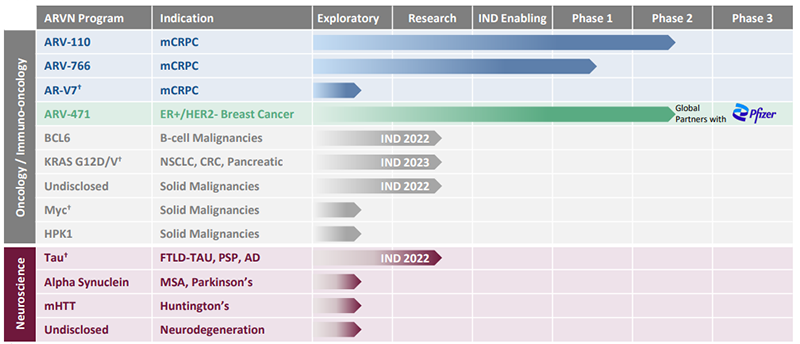
來(lái)源:Arvinas官網(wǎng)
2021 年 7 月,輝瑞與 Arvinas 達(dá)成合作,開發(fā) Arvinas 的候選口服 PROTAC 雌激素受體 (ER) 蛋白降解劑 ARV-471。圖片ARV-471 是一種通過(guò) PROTAC 技術(shù)形成的靶向雌激素受體 (ER) 的有效降解劑,可降解 ER 陽(yáng)性乳腺癌細(xì)胞系中的 ER。ARV-471 一端是泛素連接酶 E3 配體,另一端是與靶蛋白 ER結(jié)合配體,兩個(gè)配體之間通過(guò) linker 相連,從而使 ARV-471 特異性低降解 ER。目前處于 II 期開發(fā)階段,用于治療 ER+/HER2-、局部晚期或轉(zhuǎn)移性乳腺癌患者。

PROTAC結(jié)構(gòu)組成和熱門產(chǎn)品簡(jiǎn)介
靶蛋白(POI)配體
POI配體連接位點(diǎn)不同,則降解效果和選擇性都會(huì)存在很大差異。POI配體優(yōu)先選擇已有報(bào)道的具有活性的抑制劑,一般先對(duì)抑制劑進(jìn)行一些結(jié)構(gòu)衍生優(yōu)化,再作為POI配體。
靶向不同靶蛋白舉例
| POI | 原研 | 產(chǎn)品簡(jiǎn)介 |
| AR | Arvinas | ARV-110 是全球首個(gè)進(jìn)入臨床試驗(yàn)的口服生物可利用的 PRAOTC 小分子藥物,靶向 AR,2019 年 5 月獲得 FDA 快速通道批準(zhǔn),在恩雜魯胺抗性模型中,ARV-110 能明顯抑制腫瘤生長(zhǎng) |
| ER | Arvinas | ARV-471 能夠顯著降低患者腫瘤組織中的 ER 表達(dá)水平,將ER水平降低62%,最多降低接近 90%。而且,ARV-471 對(duì)野生型 ER 和 ER 突變體均表現(xiàn)出降解效果 |
| EGFR | C4 Therapeutics | CFT8919 是 EGFRL858R 的有效和選擇性 BiDAC 降解劑,EGFRL858R 是超過(guò)三分之一突變型 EGFR 肺癌腫瘤的驅(qū)動(dòng)突變 |
| IKZF1/3 | C4 Therapeutics | CFT7455 是一種靶向 IKZF1/3 的 MonoDAC 降解劑,可用于治療多發(fā)性骨髓瘤和非霍奇金淋巴瘤等。2021 年 8 月,F(xiàn)DA 授予 CFT7455 治療多發(fā)性骨髓瘤孤兒藥的稱號(hào) |
| IRAK4 | Kymera Therapeutics | KT-474 是一種有效的、高選擇性的、口服生物可利用的 IRAK4 降解劑,可用于治療 IL-1R/TLR 驅(qū)動(dòng)的免疫炎癥性病癥;適應(yīng)癥包括化膿性汗腺炎,特應(yīng)性皮炎,類風(fēng)濕性關(guān)節(jié)炎等 |
| BTK | Nurix Therapeutics | NX-2127 是一種口服的BTK降解劑,具有免疫調(diào)節(jié)藥物 (IMiD) 活性,目前在臨床I期,用于既往治療失敗的B細(xì)胞惡性腫瘤 |
E3 連接酶配體
目前已經(jīng)發(fā)現(xiàn)有 600 多種 E3 泛素連接酶復(fù)合體,研究較多的是VHL型和 CRBN型E3 泛素連接酶復(fù)合體。
比如,大家熟悉的來(lái)那度胺就是cereblon (CRBN) 的配體,來(lái)那度胺與 CRBN 結(jié)合時(shí)會(huì)招募新的底物,使其結(jié)合在 CRBN-CRL4 上,導(dǎo)致其泛素化和蛋白酶體依賴的降解增加。來(lái)那度胺是由美國(guó)新基生物制藥公司 (Celgene Corporation) 開發(fā)的抗腫瘤藥物,2005 年被 FDA 批準(zhǔn)用于治療骨髓增生異常綜合征(Myelodysplastic Syndromes),2006 年被 FDA 批準(zhǔn)用于治療多發(fā)性骨髓瘤,2013 年 6 月獲 FDA 批準(zhǔn)用于標(biāo)準(zhǔn)療法治療后復(fù)發(fā)或進(jìn)展的套細(xì)胞淋巴瘤的治療。2019 年百時(shí)美施貴寶 (BMS) 以 740 億元收購(gòu) Celgene;2020 年銷售額為 121.5億美元。目前在中國(guó)已獲批用于治療多發(fā)性骨髓瘤。
PROTAC Linker
通過(guò) linker 將靶蛋白配體和 E3 泛素連接酶配體連接起來(lái),其中 linker 的結(jié)構(gòu)和長(zhǎng)度起著至關(guān)重要的作用,因?yàn)?linker 可以影響總體 PROTAC 構(gòu)象和結(jié)合方向以及三元復(fù)合物的形成。linker 的作用遠(yuǎn)不止簡(jiǎn)單地連接兩個(gè)分子實(shí)體。它直接影響 PROTAC 的活性,選擇性和理化性質(zhì)。所以,要對(duì) E3 酶配體、linker 和靶蛋白結(jié)合進(jìn)行不斷的研究和優(yōu)化。目前針對(duì)PROTAC Linker 的研究主要是圍繞烷基或聚乙二醇(PEG)鏈來(lái)確定最佳長(zhǎng)度,修飾整體理化性質(zhì),以及優(yōu)化一些結(jié)構(gòu)(如雜環(huán),炔基)。
PROTAC技術(shù)優(yōu)勢(shì)
1、改變靶點(diǎn)的“不可成藥性”(undruggable)
PROTAC 的作用分子機(jī)制是通過(guò)泛素-蛋白酶體系統(tǒng)降解靶蛋白,并非通過(guò)競(jìng)爭(zhēng)結(jié)合以封閉靶蛋白功能區(qū)而發(fā)揮蛋白功能抑制作用,因此 PROTAC 對(duì)靶蛋白識(shí)別結(jié)合區(qū)不一定非得是活性區(qū),結(jié)合力也不一定必須是高親和力;這使得一些缺乏高親和力小分子結(jié)合的“不可成藥性”靶蛋白變成“可成藥性”。
2、高效性
傳統(tǒng)小分子抑制劑通過(guò)競(jìng)爭(zhēng)結(jié)合靶蛋白活性功能域而抑制靶蛋白功能,所需小分子的量往往較大;而 PROTAC 通過(guò)泛素-蛋白酶體系統(tǒng)降解靶蛋白以解除靶蛋白功能,故具有可循環(huán)使用性、用量低和高效性的特點(diǎn)。
3、無(wú)免疫原性
與抗體藥物相比,PROTAC 不會(huì)引發(fā)抗藥抗體產(chǎn)生。
綜上,PROTAC 已成為藥物研發(fā)領(lǐng)域的新興利器,在國(guó)內(nèi)外備受科研單位及藥企所追捧。
PROTAC技術(shù)挑戰(zhàn)與展望
PROTAC 分子量比較大,成藥性是其難點(diǎn)。同時(shí),需要尋找更多可用的 E3 泛素連接酶及其結(jié)合物。此外,還需要考慮如何改善大規(guī)模生產(chǎn)方案,提高產(chǎn)率,從而降低成本。目前 PROTAC 分子的研究進(jìn)展還主要集中在可靶向的靶點(diǎn)上,靶向不可成藥靶點(diǎn)的 PROTAC 分子未來(lái)也會(huì)被開發(fā)出來(lái),發(fā)揮出 PROTAC 技術(shù)真正的優(yōu)勢(shì),從而為一些難治性疾病的探索帶來(lái)全新的療法。
美迪西匯總了當(dāng)前流行的熱門 POI 配體,不同組織類型的E3ligase配體,并且建立了含數(shù)百種連接分子的 linker 庫(kù)。此外,美迪西成熟的計(jì)算機(jī)輔助藥物設(shè)計(jì)技術(shù)平臺(tái),大大提高 PROTAC-POI 的設(shè)計(jì)合成質(zhì)量。
參考文獻(xiàn)
[1]Si-Min Qi, et al. PROTAC: An Effective Targeted Protein Degradation Strategy for Cancer Therapy. Front Pharmacol. 2021 May 7;12:692574.
[2] Galen Andrew Collins, et al. The Logic of the 26S Proteasome. Cell. 2017 May 18;169(5):792-806.
[3]Madhusoodanan Mottamal, et al. From Pure Antagonists to Pure Degraders of the Estrogen Receptor: Evolving Strategies for the Same Target. ACS Omega. 2021 Mar 30;6(14):9334-9343.
[4]Jared A M Bard,et al. Structure and Function of the 26S Proteasome. Annu Rev Biochem. 2018 Jun 20;87:697-724.
[5]Xin Lin, et al. Targeting estrogen receptor α for degradation with PROTACs: A promising approach to overcome endocrine resistance. Eur J Med Chem. 2020 Nov 15;206:112689.
聯(lián)系我們:
電話: +86 (21) 5859-1500(總機(jī))









 相關(guān)新聞
相關(guān)新聞