業務咨詢
中國:
Email: marketing@medicilon.com.cn
業務咨詢專線:400-780-8018
(僅限服務咨詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




一 總局關于發布仿制藥參比制劑目錄的通告
自2016年11月4日仿制藥質量和療效一致性評價工作平臺參比制劑備案模塊正式上線運行以來,參比制劑備案有序進行,但卻一直不乏有企業存在變更參比制劑的情況,在參比制劑的選擇上許多企業都不盡如意。2017年4月28日,經國家食品藥品監督管理總局仿制藥質量與療效一致性評價專家委員會審核確定,對外發布了第三批,第四批仿制藥參比制劑目錄(第三批參比制劑目錄通告鏈接:http://www.sda.gov.cn/WS01/CL1751/172151.html;第四批參比制劑目錄通告鏈接:http://www.sda.gov.cn/WS01/CL1751/172152.html)。參比目錄一出,又有一大波企業抓狂,表示參比制劑選錯了,對于那些剛剛根據《關于發布企業提交參比制劑備案變更程序的通知》(詳情鏈接:http://www.nicpbp.org.cn/fzy/CL0843/9293.html)走完參比制劑變更流程的企業來說更是無語。
二 原研制劑的標桿和榜樣指導作用
原研制劑是仿制藥研發的“標桿和榜樣”,仿制藥需要保證與原研藥的體內生物利用度等效才能獲批上市,科學看待參比制劑質量,正確評估參比制劑品質,對仿制制劑的研發有重要的指導意義,尤其是面對目前仿制藥醫改時限的緊迫壓力,更要求企業在參比制劑選擇上要謹慎。針對仿制藥如何確立合適的參比制劑的研究,美迪西制劑部副總裁李國棟博士在今年3月底美迪西與廣東省藥學會制藥工程專委會等聯合舉辦的“仿制與創新”主題會議上做過詳細的介紹(會議報道鏈接:
李國棟教授當時在會議上系統介紹了仿制藥一致性評價的關鍵技術點,針對參比制劑的研究,李教授表示企業可以根據參比制劑選擇和確定原則來確定參比制劑,一定要全面查詢參比制劑相關的FDA申報資料、EMA 的assessment report、PMDA的IF文件、日本橙皮書溶出曲線和BE數據、阿根廷藥監部門公開信息等,并且強調,參比制劑的處方工藝信息有可能會出現在原研公司其他產品的專利上,需要重點關注等問題。最后還以鹽酸普羅帕酮緩釋膠囊為例予以說明,PPT詳情如下:



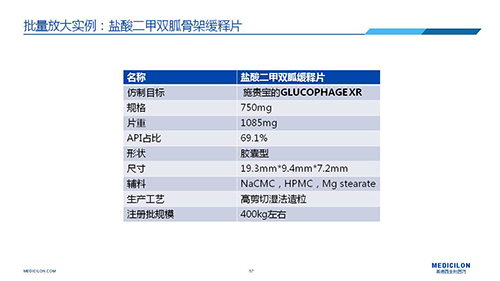
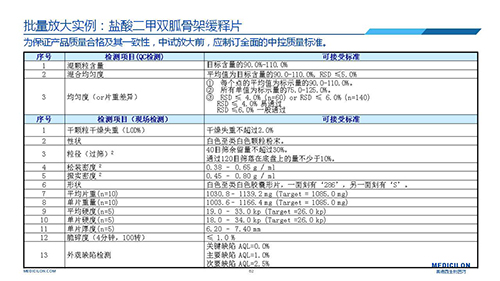
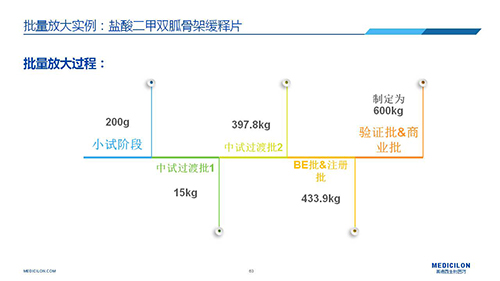
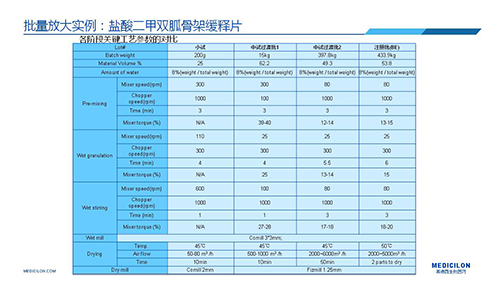
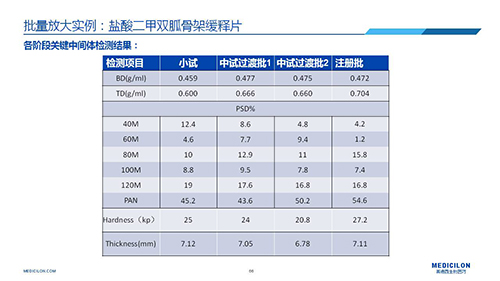
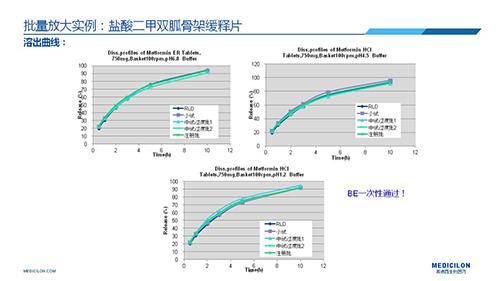
三 BE試驗一次性通過的案例——“鹽酸二甲雙胍骨架緩釋片”
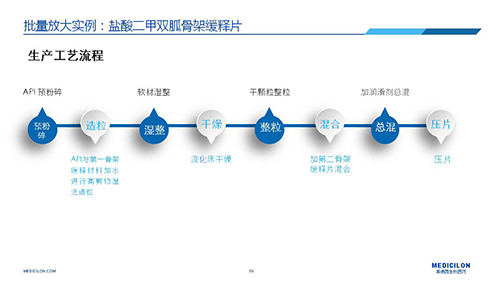
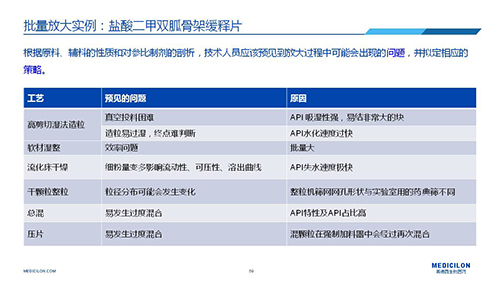
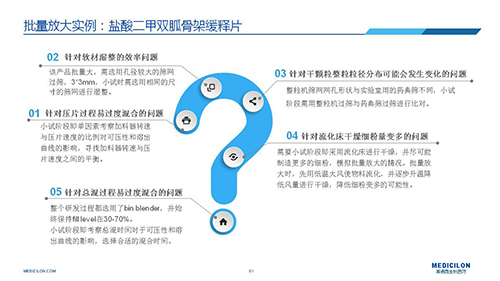
選擇合適的參比制劑是仿制藥研發成功的第一步,仿制藥一致性評價研發的關鍵目標是要穩健的處方工藝,放大到工業生產批次BE達到一致才算完成。據統計,目前估計僅100家藥物臨床機構可承接BE項目,而且市場價格高昂,因此BE一旦失敗企業將損失慘重。考慮BE失敗影響因素很多,仿制藥企業只重視參比制劑環節還遠遠不夠。因此會議上李教授分享了一個BE試驗一次性通過的案例——“鹽酸二甲雙胍骨架緩釋片”給仿制藥同行們參考,希望能有所幫助,PPT詳情如下: