



業務咨詢
中國:
Email: marketing@medicilon.com.cn
業務咨詢專線:400-780-8018
(僅限服務咨詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




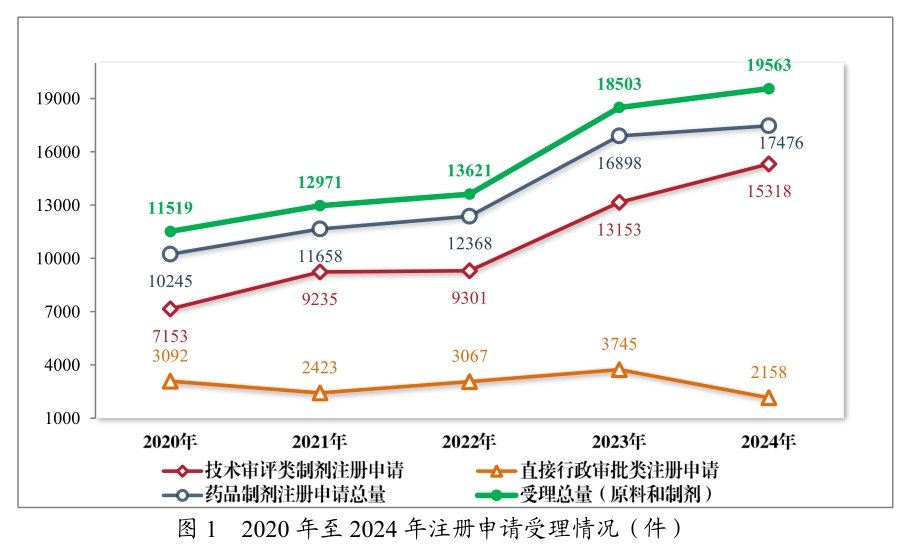
3月18日,CDE重磅發布《2024年度藥品審評報告》,全年批準48款1類創新藥、55款罕見病用藥、106款兒童用藥;受理的15318件技術審評類藥品注冊申請中,以藥品類型統計,化學藥品注冊申請10464件,中藥注冊申請2407件,生物制品注冊申請2447件。創歷史新高!這場變革背后,是政策支持、技術突破與國際協作三重紅利的共振,一個屬于中國藥企的“黃金時代”正加速到來。
1. 抗腫瘤藥頭占鰲頭,創新突圍與同質化隱憂并存
2024年批準的臨床試驗申請中,抗腫瘤藥的占比是最高,其中化學藥品是達到41.89%,生物制品達到55.43%上;91款藥物被納入突破性治療程序(2023年60款),抗腫瘤藥占比超50%。自2020年《藥品注冊管理辦法》實施以來,共有187件藥品注冊申請(135項適應癥)附條件批準上市,其中抗腫瘤藥物占比82.22%;共有496件藥品注冊申請納入優先審評審批程序,其中抗腫瘤藥物占比最多,為42.54%。
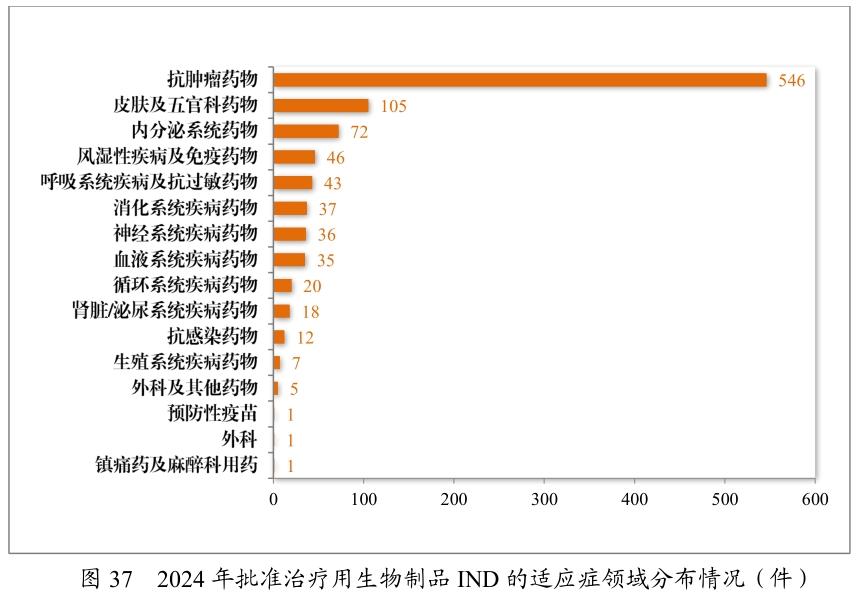
產品方面,如科濟藥業BCMA靶向CAR-T產品澤沃基奧侖賽獲優先審評、突破性治療及附條件批準三項資格,用于復發/難治性多發性骨髓瘤;傳奇生物同類CAR-T療法西達基奧侖賽通過突破性治療與附條件批準上市,適應癥同為多發性骨髓瘤;石藥集團PD-1單抗恩朗蘇拜單抗獲附條件批準,用于復發或轉移性宮頸癌患者……多款創新療法均劍指臨床急需領域,展現中國創新藥研發新突破。
但繁榮背后暗藏隱憂,PD-1/HER2等熱門靶點占據抗腫瘤藥物總量的40%,導致研發資源過度集中。以PD-1單抗為例,全球在研PD-1/PD-L1藥物超500種,中國占1/3,但首創靶點仍為空白。這種扎推式研發、同質化競爭不僅造成研發投入浪費,更可能引發未來醫保談判中的價格血戰。從工程化改良到靶點創新的戰略突圍,已成為產業轉型升級的必答題。
美迪西已構建了440+腫瘤藥效模型,包括118+種PDX模型、同種腫瘤移植模型、異種腫瘤移植模型、人源化腫瘤移植模型等,可一站式助力腫瘤藥物研發!
2. 新分子實體藥物嶄露頭角,技術革命重構研發格局
2024年,雙抗/三抗、ADC、小核酸、細胞療法等藥物的IND申請數量均創歷史新高。回溯2018-2024年,中國1類或1.1類化學藥品和生物制品的創新藥臨床試驗(IND)申請數量呈現波動上升趨勢,其中ADC藥物領域連續保持50%以上的年增長率,細胞與基因治療(CGT)領域也持續擴容。
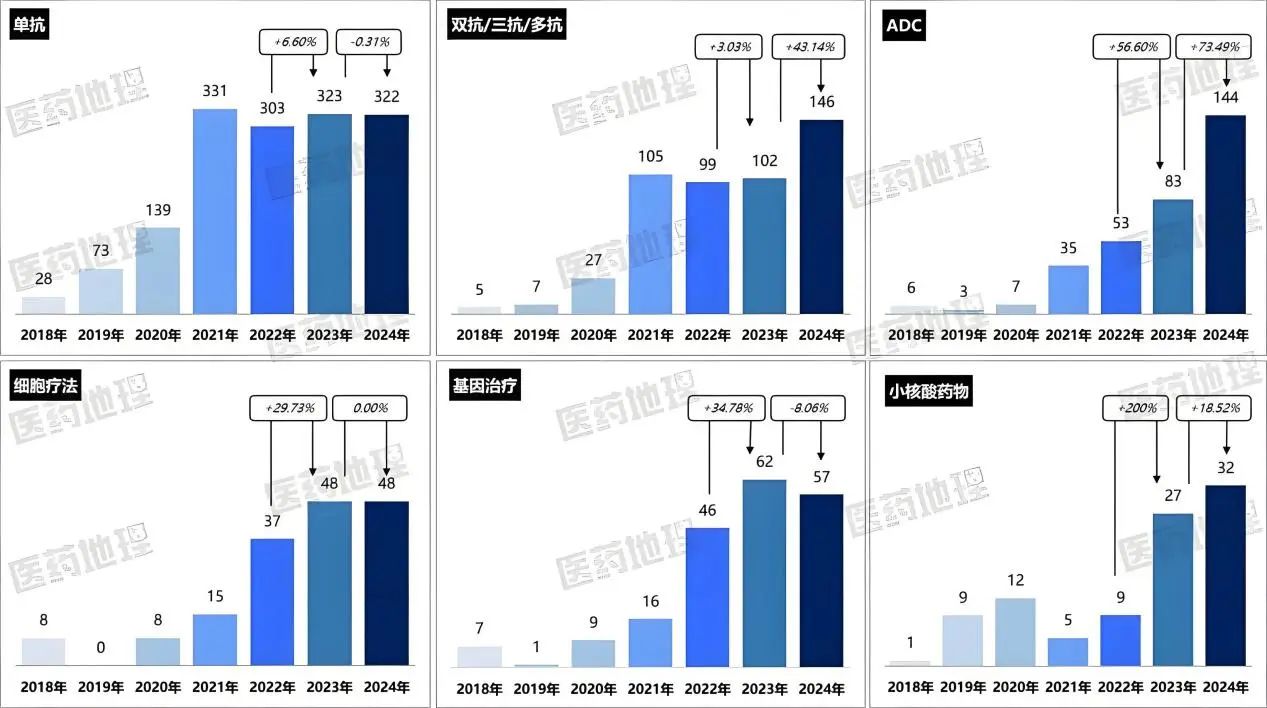
圖源:https://mp.weixin.qq.com/s/Z5PK2xWiKIzHjjNF2t06RQ
多項突破性成果令人矚目,如瑞普晨創的CiPSC胰島細胞療法進入糖尿病臨床試驗,恒瑞醫藥的PD-1/TGF-β雙抗啟動胃癌一線治療申報,榮昌生物原創ADC維迪西妥單抗第3項適應癥上市申請獲受理并納入優先審評,治療HER2陽性肝轉移晚期乳腺癌患者等。
新分子實體藥物占比提升,反映著市場藥物從Me-too向 First-in-class的轉型。隨著技術的持續進步與應用拓展,新分子實體藥物研發將迎來更多突破,推動創新藥行業向更高水平發展。
在新分子藥物研發領域,美迪西已搭建了涵蓋ADC、PROTAC、核酸、雙抗、多肽、疫苗及細胞&基因治療的新分子藥物研發服務平臺,已助力28件ADC藥物、5件PROTAC藥物、34件抗體藥物、1件核酸藥物等獲批臨床(數據截至2024年底)。
3.中藥現代化提速,迎來高質量發展新機遇
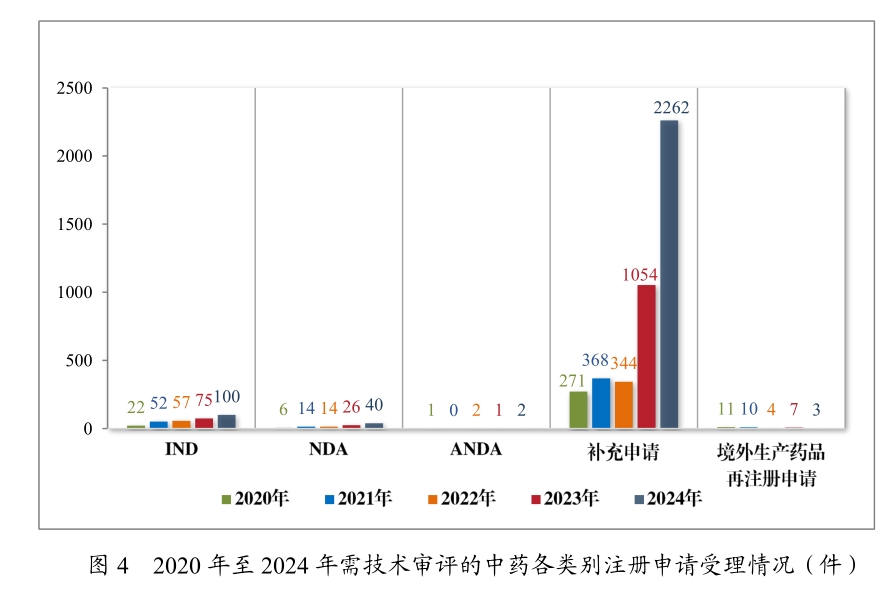
2024年,中醫藥創新迎來爆發式增長,受理中藥IND申請達100件,同比增長33.33%,其中創新中藥占比80%。在獲批的14款中藥新藥中,11款為創新中藥,呼吸、消化領域占比39.34%。古代經典名方復方制劑的NDA申請達28件,體現了對傳統中藥資源的挖掘和創新利用。
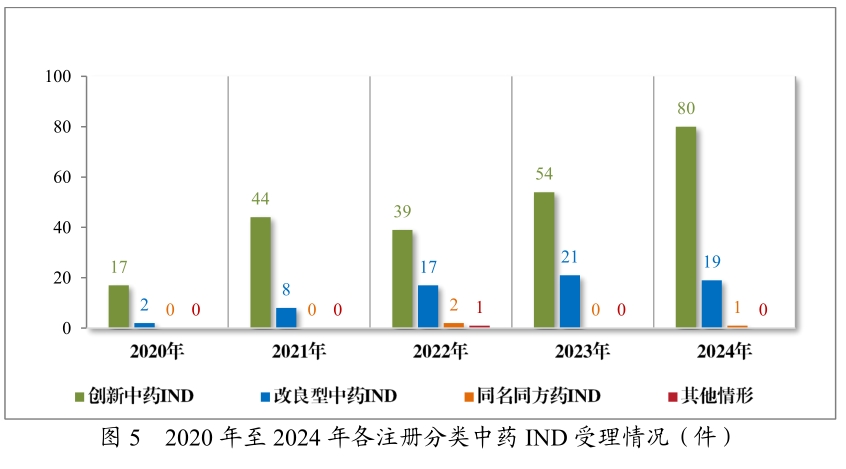
值得關注的是,1.1類新藥如齊進藥業的兒茶上清丸、卓和藥業的九味止咳口服液(針對風熱咳嗽的呼吸科"現象級"藥物)、成都華西天然藥物有限公司的秦威顆粒(首款專治急性痛風性關節炎的創新中藥),均展現出中醫藥在疑難病癥治療中的獨特價值。此外,古代經典名方復方制劑的新藥上市申請(NDA)達28件,其中9款成功獲批,如武漢康樂藥業的芍藥甘草顆粒、華潤三九的苓桂術甘顆粒及溫經湯顆粒等經典名方制劑等,實現了傳統醫學智慧的現代化轉化。
盡管當前中藥創新藥申請量僅為化學藥的五分之一,但隨著藥理學揭示多靶點協同機制、系統生物學闡明作用機理,中藥在慢性病管理、疑難病治療中的獨特優勢正逐步顯現,國際市場對植物藥和整合醫學的認可,更為中醫藥現代化提供了歷史性機遇。
在中藥領域,美迪西已搭建一站式中藥臨床前研發服務平臺,覆蓋藥學研究、藥效學、藥代動力學以及毒理學等多個關鍵環節,加速研發進程。
4.未被滿足的需求,政策東風下的創新突圍與市場藍海
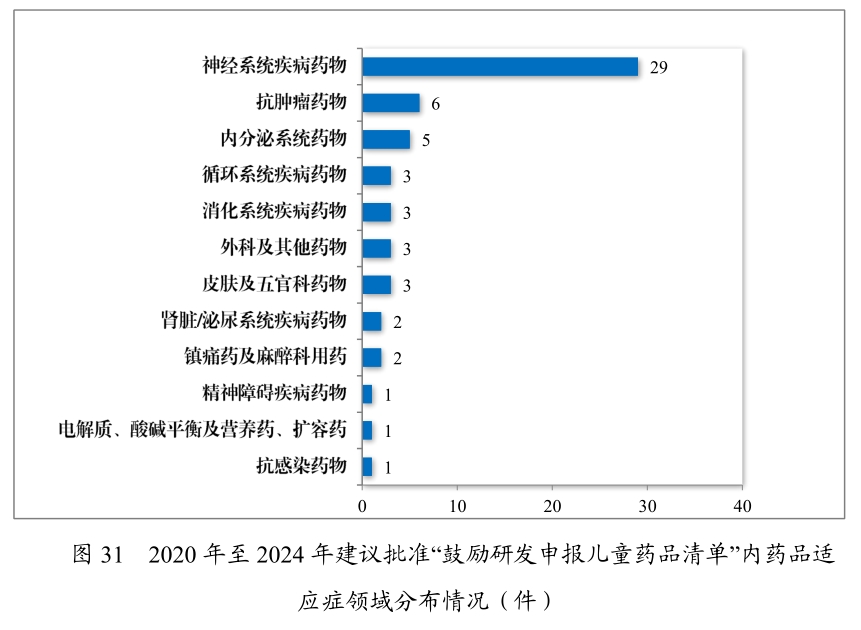
2024年,批準罕見病用藥55個品種(未包括化學藥品4類仿制藥),同比增長?40%,其中20個品種通過優先審評審批程序加快上市,2個品種附條件批準上市,覆蓋血友病、脊髓性肌萎縮癥等天價藥物;批準兒童用藥106個品種,包含71個上市許可申請,其中20個品種通過優先審評審批程序加快上市;另批準35個品種擴展兒童適應癥,緩解兒科“用藥靠掰”難題。這兩大領域長期受困于研發困境——全球7000余種罕見病僅5%有藥可治,兒童用藥因臨床試驗復雜、市場規模有限,長期依賴成人藥物劑量調整,導致不良反應風險高企。
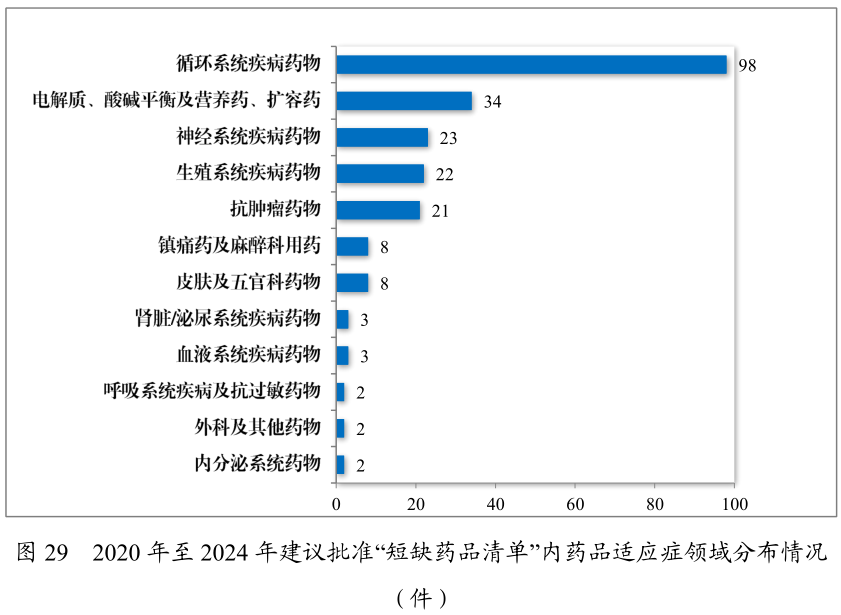
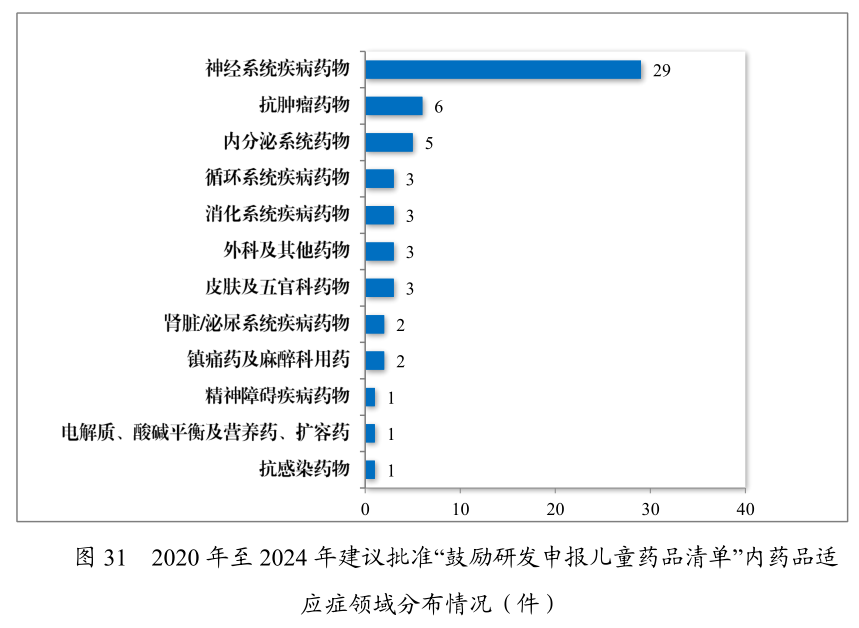
在藥品供應保障層面,政策創新持續加碼。2024年藥審中心建議批準國家短缺藥品117件(21個品種),近五年累計226件(30個品種),覆蓋循環、神經、腫瘤等12個治療領域。兒童仿制藥同步推進,藥審中心建議批準鼓勵研發申報兒童藥品清單內的兒童用仿制藥17件(14個品種),近五年累計59件(26 個品種),涉及神經、抗腫瘤、內分泌等8個治療領域,推動兒童專用口服溶液、微片劑等創新藥物研發。
罕見病、兒童用藥及短缺藥品等長期存在治療缺口的領域,不僅承載著迫切的社會醫療需求,更孕育著千億級體量的藍海市場。通過政策引導與技術創新雙輪驅動,中國正從醫藥需求的被動響應者向創新價值的主動創造者戰略轉型,在填補醫療空白的同時,推動醫藥產業向更高維度升級。
除了440+種腫瘤藥物模型,美迪西還構建了250+種非腫瘤藥效模型,包括嚙齒類、犬、小型豬、豚鼠、非人靈長類等,一站式支持罕見病藥物、兒童用藥及各類藥物的臨床前研發。
5.國際化進程加速,中美雙報成開啟全球布局的關鍵之門
2024年,中國生物醫藥國際化的進程再度加速。全年共有89款境外已上市藥品獲批,其中64款為首次引入。與此同時,中國在ICH(國際人用藥品注冊技術協調會)標準的實施上取得重大進展,已實施555項國際技術指導原則,與歐美日實施水平趨同。此外,跨境研發成為行業新常態,超百家藥企啟動中美雙報,IND申請成功率從15%大幅提升至40%。這一系列成果表明,中國藥企正以更低成本、更高效率參與全球醫藥創新競爭,加速融入全球醫藥產業鏈。
中美雙報已從可選項轉變為創新藥企業的必選項。國際標準接軌、臨床數據互認和跨境資本聯動等,為中國藥企開辟了更廣闊的市場空間,也為全球患者提供了更優質的治療選擇。
美迪西已助力60件IND項目實現中美雙報獲批,并助力21件IND項目在美國獲得FDA臨床試驗批準,在中美雙報領域積累了豐富的經驗。
未來,在政策支持持續加強、研發投入不斷增加以及技術創新深度突破的多重賦能下,中國生物醫藥產業正迎來全球化發展的黃金時代。美迪西作為一站式生物醫藥臨床前綜合研發服務平臺,將持續助力創新藥物研發,加速突破卡脖子技術瓶頸,為生物醫藥產業發展注入強勁動能。
 相關新聞
相關新聞