隨著研究人員對新藥研發(fā)的不斷探索,近年來涌現(xiàn)出了像動態(tài)蛋白(Protein Motion)、靶向蛋白降解聯(lián)合體(PROTACs)、基因轉(zhuǎn)錄模擬(Transcriptional mimetic)、小分子輔助受體靶向(SMART)等一批新興藥物研發(fā)技術(shù)。就藥物研發(fā)的總體發(fā)展來看,小分子和大分子兩種藥物形式都有各自的優(yōu)勢與不足。與此同時,基于泛素化和蛋白酶體系統(tǒng)的
PROTAC技術(shù)機理
PROTAC是一個雙功能特異性小分子,可以理解成啞鈴狀,一頭用來靶向需要降解的目標(biāo)蛋白,另一頭用來招募蛋白降解體系如E3泛素化連接酶結(jié)合,中間通過合適的linker連接。形成由“目標(biāo)蛋白-PROTAC-E3連接酶和泛素”組成的三元聯(lián)合體,使得目標(biāo)蛋白與E3連接酶空間上緊密結(jié)合,從而把目標(biāo)蛋白泛素化,進而被蛋白酶體識別并降解。這種新的機制理論上能夠靶向作用到所有的藥物靶點蛋白,尤其對之前認(rèn)為無成藥性的蛋白靶點,利用細(xì)胞自身的蛋白質(zhì)破壞機制來從細(xì)胞中去除特定致癌蛋白,從而廣泛拓展了藥物研究領(lǐng)域,為新型藥物研發(fā)提供了無法估量的空間和應(yīng)用前景。

▲像啞鈴一樣的PROTACs技術(shù)(圖片來源:David Parking)
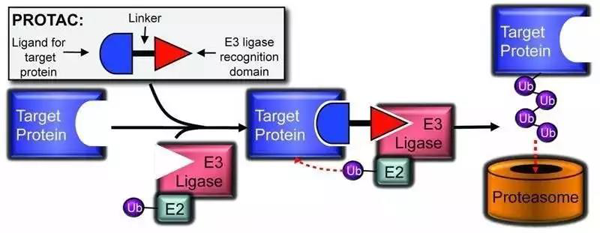
▲PROTAC技術(shù)基本模式(圖片來源:《ACS Chemical Biology》)
PROTAC技術(shù)的優(yōu)勢與缺點
PROTACs技術(shù)最大的優(yōu)勢之一是能夠使靶點從“無成藥性”(undruggable)變成“有成藥性”。大多數(shù)小分子藥物或單抗需要結(jié)合酶或受體的活性位點來發(fā)揮作用,然而,據(jù)估計,人類細(xì)胞中80%的蛋白缺乏這樣的位點。而PROTACs可以通過任何角落、縫隙抓住靶蛋白。通過PROTACs技術(shù)靶向這些蛋白可能會在疾病治療中帶來前所未有的突破。
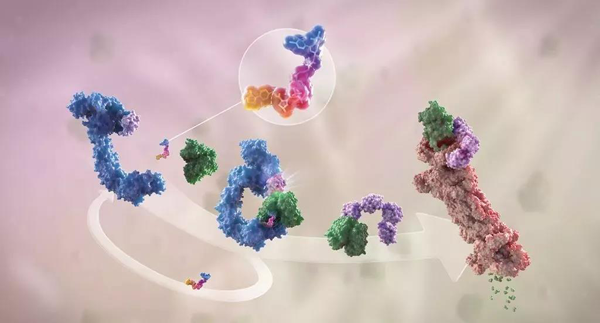
▲蛋白降解劑(多色)結(jié)合了1個靶蛋白(綠色)和1個E3泛素連接酶(藍(lán)色),驅(qū)動基于蛋白酶體(橙色)的靶蛋白泛素化(紫色)和降解。(圖片來源:Arvinas)
PROTAC 在很大程度上是結(jié)合了小分子化合物和小分子核酸的優(yōu)點,即可以有效地靶向目標(biāo)蛋白,又可以將之降解清除,想象空間非常豐富。與此同時,PROTAC也有它的硬傷,比如分子通常很大,PK是一個主要障礙。化學(xué)合成也困難得多,CMC也是一個很大的挑戰(zhàn)。
脫靶毒性應(yīng)該是業(yè)界最為關(guān)注的問題之一。傳統(tǒng)靶向蛋白活性的小分子、大分子藥物,甚至小核苷酸,一般來講對蛋白活性的抑制不會太徹底,也多不影響骨架蛋白的表達(dá),這樣固然增加了耐藥性發(fā)生的概率,但同時殘留的活性也可能保障了正常細(xì)胞、組織器官基本的生理活性,降低了潛在毒性。而PROTAC作為更為徹底的靶標(biāo)降解者,即使是以前驗證過的靶點,會不會帶來更為嚴(yán)重的毒性,需要在未來的臨床實驗中密切監(jiān)視。
另一個隱患是降解的脫靶效應(yīng)在臨床前毒性篩選中不易檢測、跟蹤,增加了后期開發(fā)的風(fēng)險。
PROTAC面臨的機會與挑戰(zhàn)
PROTAC小分子研究最近的突破還主要集中在可靶向的靶點上,它的未來最大潛力之一是要靶向傳統(tǒng)不可靶向的靶點,比如轉(zhuǎn)錄因子、蛋白的骨架功能等,或是不可成藥的靶點之王KRAS突變。高達(dá)20-30%的腫瘤中含有KRAS突變,包括90%以上的胰腺癌、50% 的結(jié)腸癌、30%的肺癌等。
同時,PROTAC小分子既可以單用于克服傳統(tǒng)靶向藥物的耐藥性,也是將來一個組合療法的利器,前景非常值得期待。
PROTAC技術(shù)的前景與展望
作為新技術(shù),PROTACs未來還有很多路要走。除了技術(shù)升級,為了走向臨床,科學(xué)界和工業(yè)界需要克服PK、PD、生物利用度、給藥方式等各方面的成藥性問題。任何一類藥物的研發(fā)都需要厚積薄發(fā)。只有更扎實的研究、更廣泛的投入才能幫助PROTACs真正成藥。目前,PROTAC技術(shù)已然進入臨床,未來成長空間巨大、前景廣闊毋庸置疑。
聯(lián)系我們
Email: marketing@medicilon.com.cn
電話: +86 (21) 5859-1500(總機)










