



業(yè)務(wù)咨詢
中國(guó):
Email: marketing@medicilon.com.cn
業(yè)務(wù)咨詢專線:400-780-8018
(僅限服務(wù)咨詢,其他事宜請(qǐng)撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




近年來全球生物藥市場(chǎng)增長(zhǎng)迅速,其中主要產(chǎn)品包括重組胰島素,人生長(zhǎng)激素(HGH)和各種單克隆抗體(單抗mAbs)等。隨著許多暢銷的生物藥專利逐漸到期、降低醫(yī)療成本壓力的需求、以及新藥研發(fā)日益增加的難度,生物仿制藥市場(chǎng)顯示出強(qiáng)勁的發(fā)展?jié)摿ΑI锓轮扑帋淼臋C(jī) 會(huì)及發(fā)展趨勢(shì)也成為醫(yī)藥界關(guān)注的焦點(diǎn)。同時(shí),許多國(guó)家也正逐步完善生物仿制藥的審批政策,幫助生物仿制藥市場(chǎng)迎向快速發(fā)展的新時(shí)期。
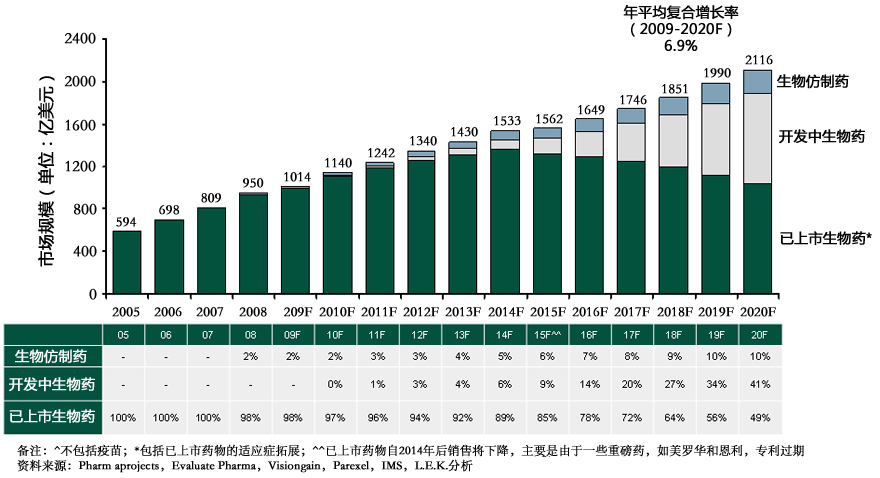
2005-2020年生物仿制藥、開發(fā)中生物藥、已上市生物藥發(fā)展預(yù)測(cè)
目前中國(guó)生物藥市場(chǎng)大約占整個(gè)中國(guó)藥品市場(chǎng)的20-30%,增速很快并且市場(chǎng)份額將會(huì)持續(xù)增長(zhǎng)。已上市產(chǎn)品基本上是生物仿制藥,原研產(chǎn)品較少規(guī)模也相對(duì)較小,多為有特定市場(chǎng)的專科用藥譬如腫瘤藥。原研單抗藥物廠家,主要為外資主導(dǎo),正持續(xù)擴(kuò)展鋪貨渠道增加市場(chǎng)占有率。發(fā)展初期可能注重于大城市大醫(yī)院,但現(xiàn)在逐漸開始覆蓋到其它重要省會(huì)和中心城市。在中長(zhǎng)期的規(guī)劃中,預(yù)計(jì)未來二三線城市會(huì)達(dá)到一線城市覆蓋率水平。即使是傳統(tǒng)觀念認(rèn)為價(jià)格較貴的生物藥,未來也會(huì)有很好的發(fā)展空間。
目前國(guó)內(nèi)生物制藥公司主要提供生物仿制藥概念的產(chǎn)品,一般是市場(chǎng)上比較成熟的藥。新藥在國(guó)內(nèi)市場(chǎng)大部分仍在快速發(fā)展階段,雖然大多為外資主導(dǎo),國(guó)內(nèi)廠商也不乏發(fā)展機(jī)會(huì)。例如中國(guó)的胰島素市場(chǎng)規(guī)模非常大,有些國(guó)內(nèi)廠家嘗試進(jìn)入,比如通化東寶,但整體規(guī)模目前都很小。未來預(yù)計(jì)會(huì)有更多的國(guó)內(nèi)廠家嘗試進(jìn)入這些像是胰島 素及單抗類產(chǎn)品相對(duì)較高端的市場(chǎng)。
國(guó)內(nèi)生物制藥公司想做單抗的公司非常多,主要分為兩類:第一類包括中信國(guó)健,江蘇泰康,百泰生物等,都是海歸回國(guó)后吸收小規(guī)模人群組建技術(shù)公司。這些公司大多處于較早的產(chǎn)品技術(shù)研發(fā)階段。第二類是比較傳統(tǒng)的生物醫(yī)藥公司,比如沈陽三生,一般利 用現(xiàn)有的生物行業(yè)技術(shù)經(jīng)驗(yàn)進(jìn)入單抗領(lǐng)域。
中國(guó)的單抗市場(chǎng)目前主要分為腫瘤和風(fēng)濕免疫,抗排異市場(chǎng)相對(duì)小很多。在單抗市場(chǎng)中,其中有9個(gè)進(jìn)口的原研單抗。仿制藥方面,已上市產(chǎn)品包括中信國(guó)健的益賽普,上海賽金的強(qiáng)克和百泰生物的泰欣生。
相對(duì)單抗來說,像EPO之類的第一代生物藥,雖然普及率較高,但是市場(chǎng)空間或者發(fā)展?jié)摿Σ⒉患皢慰梗驗(yàn)槭袌?chǎng)滲透率已較高且競(jìng)爭(zhēng)非常激烈,若沒足夠優(yōu)勢(shì),再追加投入并不值得。
對(duì)于國(guó)內(nèi)的生物仿制藥企業(yè),還存在著產(chǎn)品定價(jià)的問題。以中國(guó)EPO市場(chǎng)為例,進(jìn)口產(chǎn)品Kirin的利血寶價(jià)格為國(guó)產(chǎn)仿制藥的4倍,同時(shí)擁有較高的市場(chǎng)份額。國(guó)內(nèi)產(chǎn)品只能采取價(jià)低價(jià)競(jìng)爭(zhēng),造成整個(gè)市場(chǎng)競(jìng)爭(zhēng)激烈,利潤(rùn)空間小。除了三生之外,其他國(guó)內(nèi)企業(yè)的份額大多很小。由此可見,今后中國(guó)企業(yè)做仿制單抗,如何在價(jià)格方面有所突破且避免惡性競(jìng)爭(zhēng)將是一個(gè)必須要考慮的問題。
相對(duì)化學(xué)仿制藥,生物仿制藥的注冊(cè)更加復(fù)雜并且是進(jìn)入市場(chǎng)的主要關(guān)鍵。根據(jù)中國(guó)藥品注冊(cè)法規(guī),除了正常申請(qǐng)臨床試驗(yàn)批件和生產(chǎn)/進(jìn)口批件的流程,化學(xué)藥的仿藥的臨床試驗(yàn)僅需要完成生物等效性實(shí)驗(yàn)。但是對(duì)于生物仿制藥,按照現(xiàn)行的規(guī)定則需按照新藥注冊(cè)且必須進(jìn)行完整的臨床試驗(yàn)。雖然某些情形下可以跳過第I、II期試驗(yàn),但第III期臨床試驗(yàn)是必須要完成的。相應(yīng)地,生物仿制藥的注冊(cè)時(shí)間和經(jīng)濟(jì)成本都會(huì)增加,譬如如果臨床試驗(yàn)觀察終點(diǎn)和指標(biāo)不同,成本也會(huì)不 同。
目前國(guó)內(nèi)很多大藥廠都在開發(fā)治療風(fēng)濕免疫/腫瘤的單抗藥物。此類藥物通常需要進(jìn)行大樣本量的第III期臨床試驗(yàn),僅試驗(yàn)本身一般就要耗時(shí)兩三年,如果以總生存期為觀察終點(diǎn),試驗(yàn)時(shí)間和成本還將更高。同時(shí)從對(duì)臨床試驗(yàn)的要求趨勢(shì)來看,不管是醫(yī)生(醫(yī)院的道德委員會(huì))和SFDA,今后對(duì)于入組臨床試驗(yàn)的病人可能會(huì)要求選擇目前市面上公認(rèn)相對(duì)好的治療方法,而不是隨便取一個(gè)簡(jiǎn)單的治療方案作對(duì)照,因此未來臨床試驗(yàn)的成本 有大幅增加的趨勢(shì)。
舉例來說,中信國(guó)健在2001年做益賽普 (Etanercept) 臨床試驗(yàn)的時(shí)候,由于原研藥在國(guó)內(nèi)還沒有上市,所以只需與普通的抗風(fēng)濕藥物(DMARDs)做對(duì)比即有可能獲得SFDA批準(zhǔn)。但如果四五年后有其它公司要 做類似的新仿制藥,則有可能被SFDA要求與依那西普(Etanercept)原研藥(恩利Enbrel)做對(duì)照試驗(yàn),以證明在研產(chǎn)品有和依那西普(Etanercept)有相似的療效。如果這樣,根據(jù)目前對(duì)于臨床試驗(yàn)例數(shù)的要求,實(shí)驗(yàn)組需要有300例病人(不考慮病人脫落的情形),同時(shí)開發(fā)新藥的公司必須免費(fèi)提供對(duì)照組約 100-150例病人6個(gè)月的恩利,試驗(yàn)成本將大大高于以往只供應(yīng)普通抗風(fēng)濕藥的費(fèi)用。
由此可見,生物仿制藥在本身研發(fā)難度 之外,其注冊(cè)耗時(shí)長(zhǎng)、臨床試驗(yàn)成本高的特點(diǎn)也將成為另一種形式的壁壘。一些小公司可能覺得做化學(xué)仿制藥很容易,但是做生物仿制藥這一塊將會(huì)遇到很大的資金 壁壘。即使對(duì)有雄厚研發(fā)實(shí)力的公司,可能也還需借助社會(huì)資本和金融資本來加速產(chǎn)品開發(fā)。
目前中國(guó)尚無區(qū)分生物原研藥和仿制藥的注冊(cè)相關(guān)規(guī)定,所有生物藥都作為新藥進(jìn)行審批。雖然還沒有出臺(tái)注冊(cè)相關(guān)規(guī)定,第III期臨床試驗(yàn)都將是必須的。這是因?yàn)閷?duì)于原研藥廠家來講,制造生物藥的過程和步驟非常重要,不僅考慮身體吸收程度的藥代動(dòng)力學(xué)(PK)方面的比較。由于生物仿制藥實(shí)際上并不是真正完全跟生物原研藥一樣而只是在某些性質(zhì)上相似,其有效性和安全性需要更仔細(xì)的研究及驗(yàn)證。舉例來說,在歐洲,一個(gè)生物藥廠換址,其產(chǎn)品都可能發(fā)生變化并需要嚴(yán)格的監(jiān)管,甚至有可能被要求重新進(jìn)行臨床試驗(yàn)。因此未來生物仿制藥不做III期試驗(yàn)就注冊(cè)的可能性很低,但I(xiàn)II期臨床的規(guī)模和試驗(yàn)方式或有討論空間。
除了臨床實(shí)驗(yàn)的相關(guān)規(guī)定,目前歐洲的注冊(cè)規(guī)定允許如果一個(gè)藥有多個(gè)不同適應(yīng)癥,只需做一個(gè)適應(yīng)癥的臨床試驗(yàn),而其他適應(yīng)癥只需要做生物等效性實(shí)驗(yàn)。因此通常節(jié)省一個(gè)生物仿制藥開發(fā)費(fèi)用的方式之一是選擇其市場(chǎng)最大的或最容易證明的適應(yīng)癥做臨床試驗(yàn),再擴(kuò)展適應(yīng)癥。值得注意的是,考慮到每一個(gè)生物藥都有不同的特性,在歐洲大部分生物藥的試驗(yàn)要求都會(huì)根據(jù)每個(gè)案例的不同而有所變化。注冊(cè)規(guī)定一般只提供基本框架,更多細(xì)節(jié)是通過與政府監(jiān)管部門的討論制定出來。對(duì)于用于治療癌癥的生物仿制藥,由于治療周期短,與政府討論空間也較多。
隨著各國(guó)生物仿制藥的審批政策的出臺(tái),這些新的政策對(duì)于中國(guó)有很高的參考價(jià)值。根據(jù)生物谷(Bioon.com)的報(bào)導(dǎo),國(guó)家食品藥品監(jiān)督管理局(SFDA)注冊(cè)司生物制品處副處長(zhǎng)常衛(wèi)紅在上海召開的2012中國(guó)抗體藥物研發(fā)與產(chǎn)業(yè)化國(guó)際峰會(huì)暨項(xiàng)目合作洽談會(huì)上表示,生物仿制藥指南制定的前期工作正在規(guī)劃中。生物仿制藥指南準(zhǔn)備工作將包含調(diào)研、起草、實(shí)施的三個(gè)步驟。其中調(diào)研這部分工作已經(jīng)開始,包括政策、質(zhì)量控制、臨床前研究及臨床研究。指南內(nèi)容將會(huì)匯集包 括科學(xué)家、研究者、國(guó)內(nèi)外企業(yè)家等組成的顧問團(tuán)隊(duì)所提供的意見。對(duì)照品設(shè)定、技術(shù)問題、相似度的審查難度及效益考慮等都將是指南需要研究的問題。
目前國(guó)內(nèi)對(duì)于生物的規(guī)劃有很多,例如發(fā)改委的生物產(chǎn)業(yè)規(guī)劃中覆蓋面包括醫(yī)藥工業(yè),生物醫(yī)藥,生物產(chǎn)業(yè)等。“十二五”生物醫(yī)藥產(chǎn)業(yè)規(guī)劃中單克隆抗體藥物研究也 被列入國(guó)家重點(diǎn)項(xiàng)目。未來幾年隨著產(chǎn)業(yè)規(guī)劃啟動(dòng),中央財(cái)政扶持資金四百個(gè)億的也將陸續(xù)投入。工信部也從生物科技角度制定了發(fā)展規(guī)劃,內(nèi)容包含很廣,從診斷 到農(nóng)業(yè)技術(shù)都有涵蓋。但是工信部的規(guī)劃在內(nèi)容和目標(biāo)上并沒有特別針對(duì)生物藥,主要討論提高產(chǎn)業(yè)升級(jí)。比如說政府希望未來一類新藥達(dá)到25個(gè),并沒有說明其 中化學(xué)與生物藥的比例。
此外,許多生物企業(yè)表示政府在逐漸加大對(duì)產(chǎn)品研發(fā)的支持。其中可能的趨勢(shì)是從研究機(jī)構(gòu)牽頭轉(zhuǎn)為企業(yè)牽頭,先由企業(yè)發(fā)起,再加入大學(xué)等研究機(jī)構(gòu)。因?yàn)檠芯繖C(jī)構(gòu)牽頭往往沒有可商業(yè)化的成果,而企業(yè)牽頭有助于研究成果的商業(yè)轉(zhuǎn)化。
地 方政府對(duì)于生物制藥產(chǎn)業(yè)也提供很多優(yōu)惠政策,包括稅收和財(cái)政上的支持,或者從更直接的藥物定價(jià)及醫(yī)保的影響。如中信國(guó)健的益賽普,在上海就有住院病人的補(bǔ) 貼政策,雖然這個(gè)補(bǔ)貼在申請(qǐng)過程中遇到了很多困難:上海政府認(rèn)為單抗國(guó)內(nèi)領(lǐng)頭企業(yè)及地方企業(yè)應(yīng)該享有優(yōu)惠政策;同時(shí)卻也需要顧慮醫(yī)保成本承擔(dān)太多,最后僅 允許在住院病人這里醫(yī)保,雖然實(shí)際情況是益賽普多用于門診病人,而少用于住院病人。
對(duì)于國(guó)內(nèi)的大型藥企,如何建立內(nèi)部系統(tǒng)流程來增加新生物藥產(chǎn)品非常重要。其中一種可能的途徑是與海歸人士合作成立公司。比如復(fù)星在美國(guó)有投資一家小的公司專門做前期研發(fā)。這家小的公司剛開始的模式就是海歸人士做單抗的研究,回國(guó)后與復(fù)星投資成立公司,其中復(fù)星投資占80%股份。
海外并購有成熟技術(shù)的國(guó)外企業(yè)也有可能加速開發(fā)單抗的進(jìn)程。一種方式是投資國(guó)外的公司,幫助其技術(shù)團(tuán)隊(duì)增長(zhǎng),再利用他們資源在中國(guó)發(fā)展。例如藥明康德就在美國(guó)并購了專門做生物這一方面的生物醫(yī)藥研發(fā)外包公司(CRO),再把美國(guó)技術(shù)引進(jìn)到中國(guó)。
在當(dāng)前的經(jīng)濟(jì)情況下,并購美國(guó)公司不一定比中國(guó)公司貴。因?yàn)橥顿Y者預(yù)期中國(guó)市場(chǎng)增長(zhǎng)率高,中國(guó)公司的市盈率倍數(shù)非常高,而美國(guó)現(xiàn)在給生物企業(yè)的估值相對(duì)中國(guó)來說較低。在2007年金融危機(jī)之后,美國(guó)有很多有好技術(shù)但是缺乏資金的公司面對(duì)資金短缺的壓力且沒辦法往下一步發(fā)展。中國(guó)企業(yè)若有機(jī)會(huì)像復(fù)星一樣投資這些企業(yè)可能會(huì)是不錯(cuò)的合作機(jī)會(huì)。若能并購到的企業(yè)有較為成熟的生物藥且市場(chǎng)規(guī)模較大,更可以直接引入中國(guó)做新藥。
通常在美國(guó)歐洲現(xiàn)行的中小型公司模式是將生物技術(shù)直接外包給合同生產(chǎn)外包廠家(CMO),發(fā)展到一定階段再自建或委托生產(chǎn)。把并購的公司所有營(yíng)運(yùn)移到中國(guó)不一定是個(gè)很好的模式,將研發(fā)與技術(shù)留在美國(guó)或歐洲而把生產(chǎn)遷到中國(guó)或許是一個(gè)更好的選擇。
生物仿制藥在中國(guó)有很大的市場(chǎng)發(fā)展?jié)摿ΑN磥韼啄觌S著政府在生物醫(yī)藥產(chǎn)業(yè)規(guī)劃的重點(diǎn)開展,生物制品研發(fā)的加速和醫(yī)藥內(nèi)需的擴(kuò)大,市場(chǎng)預(yù)計(jì)將以非常快速的速度增長(zhǎng)。目前主要面臨技術(shù)和監(jiān)管方面的難題及不確定性。國(guó)內(nèi)生物仿制藥未來發(fā)展的機(jī)遇將主要取決于這兩方面的發(fā)展。
在技術(shù)層面,國(guó)內(nèi)藥企生物藥品的研發(fā)、臨床研究及制藥等的技術(shù)水平跟生產(chǎn)工藝等都難以與國(guó)外相競(jìng)爭(zhēng)。生物仿制藥在生產(chǎn)復(fù)雜性及仿制難度等方面都比化學(xué)仿制藥高出許多,需要一個(gè)公司具備扎實(shí)的藥品研發(fā)知識(shí)、經(jīng)驗(yàn)和技術(shù)。這些條件對(duì)希望進(jìn)入生物仿制藥市場(chǎng)的公司提出了更高的要求。不過國(guó)內(nèi)的生物仿制藥企業(yè)正積極 地投資研發(fā)團(tuán)隊(duì)及設(shè)備,并期望能縮小與國(guó)外廠家的差距。
在監(jiān)管方面,生物仿制藥的監(jiān)管法規(guī)包括注冊(cè)管理、標(biāo)準(zhǔn)化與質(zhì)量控制等都尚未明確。由于生物藥的驗(yàn)證比化學(xué)藥更加復(fù)雜,制定監(jiān)管政策的難度也相對(duì)提高。此外目前所有生物藥都按照新藥的流程進(jìn)行審批,導(dǎo)致了生物仿制藥高昂的研 發(fā)成本和漫長(zhǎng)的研發(fā)周期。隨著未來生物仿制藥指南的出臺(tái),市場(chǎng)的不確定性將降低,較新藥簡(jiǎn)略的監(jiān)管法規(guī)也將大力推動(dòng)生物仿制藥的發(fā)展。
目前中國(guó)生物藥市場(chǎng)大多是仿制藥及缺乏技術(shù)含量并較普遍的藥品,單抗、疫苗和重組蛋白領(lǐng)域等較高端的生物藥市場(chǎng)主要為高價(jià)的原研藥,且品種較少。隨著眾多原研藥專利到期、高端的生物藥使用率性提高和生物仿制藥簡(jiǎn)略申請(qǐng)政策出臺(tái),如果能在技術(shù)和監(jiān)管方面提供良好的條件,生物仿制藥有機(jī)會(huì)成為未來醫(yī)藥業(yè)的發(fā)展亮 點(diǎn)。
越來越多的中國(guó)醫(yī)藥公司開始進(jìn)入到生物仿制藥領(lǐng)域尤其是單抗仿制藥領(lǐng)域,由于在該領(lǐng)域所需要的巨額投資,L.E.K.咨詢建議每個(gè)希望進(jìn)入的國(guó)內(nèi)醫(yī)藥公司在開始投入之前先衡量一下自己的實(shí)際情況和發(fā)展規(guī)劃:
? 公司是否已經(jīng)有生物制藥業(yè)務(wù),不管是自然提取還是重組技術(shù)?如果沒有,公司認(rèn)為自己能夠在這個(gè)新興領(lǐng)域取得成功有哪些支持?
? 公司如何能夠快速建設(shè)自己的生物仿制藥能力?公司是傾向于自主技術(shù)開發(fā)還是通過技術(shù)轉(zhuǎn)讓(通過技術(shù)收購或者其他合作形式)亦或是收購的形式?
? 與眾多潛在的內(nèi)資和外資生物仿制藥的競(jìng)爭(zhēng)對(duì)手相比,公司有哪些特別之處?公司是否在自己所規(guī)劃的未來生物仿制藥所在的治療領(lǐng)域,如腫瘤或者風(fēng)濕科,擁有有競(jìng)爭(zhēng)力的產(chǎn)品和業(yè)務(wù)基礎(chǔ)?
? 公司是只專注于中國(guó)國(guó)內(nèi)市場(chǎng),還是國(guó)際市場(chǎng)也是未來的發(fā)展方向?
? 如果國(guó)際市場(chǎng)也是未來份額發(fā)展計(jì)劃之一,那么打算在什么時(shí)間點(diǎn)拓展,拓展到哪些地區(qū)?公司如何預(yù)先規(guī)劃以在亞洲、拉丁美洲、歐洲和美國(guó)市場(chǎng)獲得收益?
未雨綢繆,規(guī)劃一個(gè)清晰的戰(zhàn)略對(duì)于所有的公司和業(yè)務(wù)永遠(yuǎn)是一個(gè)正確的選擇。對(duì)于生物仿制藥業(yè)務(wù)而言尤其如此,因?yàn)榫鸵粋€(gè)單抗仿制藥的開發(fā)、注冊(cè)、生產(chǎn)和營(yíng)銷 的總成本至少要上億元。如果中國(guó)醫(yī)藥企業(yè)只是重現(xiàn)九十年代大舉進(jìn)入重組蛋白生產(chǎn)的“淘金潮”,這對(duì)于中國(guó)生物醫(yī)藥產(chǎn)業(yè)的聲譽(yù)和發(fā)展都是無利甚至有害的。首 先注重取得優(yōu)質(zhì)的、穩(wěn)定的技術(shù),高規(guī)格的質(zhì)量順準(zhǔn)以及臨床上優(yōu)異的結(jié)果,那么整個(gè)中國(guó)生物仿制藥產(chǎn)業(yè)在未來將獲得更大、更長(zhǎng)遠(yuǎn)的成功。
 相關(guān)新聞
相關(guān)新聞