



業(yè)務咨詢
中國:
Email: marketing@medicilon.com.cn
業(yè)務咨詢專線:400-780-8018
(僅限服務咨詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




新藥研發(fā)中,工藝質量標準在IND階段的建立扮演著至關重要的角色。這些標準不僅僅是規(guī)定,更是保障藥物品質的基石,對整個研發(fā)過程有著深遠的影響。工藝質量標準的確立能夠確保生產(chǎn)的一致性,降低生產(chǎn)風險,確保未來產(chǎn)品質量的穩(wěn)定性,也為臨床試驗的的可靠性奠定基礎;
美迪西云講堂CMC專題直播第三期,特別邀請了在藥物分析領域擁有豐富經(jīng)驗的王貴芳老師做客云講堂,對于IND階段質量標準有什么難題和困惑,讓我們一起聽聽王老師的解惑時間!
歡迎點擊鏈接“http://www.zd69.cn/video/process-quality-standards.shtml”,觀看直播回顧王老師的整場分享。
問:什么情況下需要加入熔點檢測項呢?
答:熔點檢測項是反應原料藥物理性質以及純度的檢測項,常規(guī)情況下都會定入。但如果熔融的時候同時分解或者碳化,那么熔點可能會檢測不到,這是沒有意義的。那么在經(jīng)過研究以后,我們就不會訂入質量標準了。因此,一般情況下我們首先要對它進行研究,如果能找到合適的方法,是需要把熔點定入質量標準中。
問:怎么確定原料藥哪些研究項目需要訂入質量標準?
答:可以回看直播中檢測項的具體介紹。具體需要看原料藥的性質,比如是注射劑還是口服制劑,選擇對應的檢測項。比如旋光度是手性中心藥物需考察項。如果是特殊原料藥需要額外考察一些性狀。除此之外,都盡量訂入質量標準中,除非是類似之前的問題提到的,研究后發(fā)現(xiàn)熔融的時候同時分解碳化,那么就不適合放入標準中。

因此研究思路就首先把這些檢測項都找出來,然后對它進行研究,研究后將合適的訂入標準,這樣才能保證檢測項比較全面。
問:雜質譜需要被毒理批次覆蓋是什么意思?
答:雜質譜是雜質的種類,比如GMP批次的樣品里面有雜質01,雜質02,雜質03,以及特定雜質RRT0.32, 這四個雜質。那最好毒理批次中也有雜質01,雜質02,雜質03,以及特定雜質RRT0.32,這樣就是雜質譜一致,GMP批次雜質譜是被毒理批次覆蓋的。
另外,我們通常指的被覆蓋也會指它的雜質水平,就比方說GMP批次有雜質01,雜質02,雜質03以及特定雜質RRT 0.32,當GMP批次的雜質小于毒理批次中的這幾個雜質水平,就可以稱之為被覆蓋了。
問:多大的雜質會確定結構去預測基毒,還是預測基毒從已知雜質去預測就行?
答:預測基毒和雜質水平?jīng)]有太大的關系,如果是一類或二類雜質,可能含量很低就會影響藥物的安全性。當前有關物質的方法,檢測結果未檢出,只是基于當前方法的靈敏度的結果。尤其是對非癌癥類藥物,對申報路線里有的起始物料,中間體,以及已知結構的雜質,我們都會去進行預測。如果是未知雜質的話,是無法預測的。因為軟件預測的前提是需要目標化合物結構,把結構輸入到對應的軟件中,會得到目標結構的模擬報告。
問:后期對于以RRT形式報告的雜志如何進行準確歸屬?萬一由于不同儀器導致RRT值改變了呢?
答:在I期申報過程中,我們的方法的耐用性考察相對較少。因此,我們以RRT形式報告的雜質,有時候確定歸屬確實是一項挑戰(zhàn)。但我們有毒理批次,當歸屬問題困擾時,可以將毒理批次作為對照批次,這樣就能避免歸屬不準確的可能性。
儀器的差異,在同一序列,對不同批次樣品的影響是一致的。因此,使用毒理批次的樣品作為對照能夠有效防止歸屬錯誤。
問:仿制藥項目藥典中提到重金屬,現(xiàn)在我們新增元素雜質檢項,重金屬還需要做嗎?
答:仿制藥申報時比較看重已有標準,比如各國的藥典。藥典中有的檢測項,建議保留。我們在做很多仿制藥的申報項目時,我們尊重原有的藥典標準,保留重金屬檢測項的同時,也會根據(jù)ICH Q3D進行元素雜質的研究。以確保仿制藥在變數(shù)雜質水平上是安全的。
問:GMP 0.3%的雜質需要做動物實驗嗎?
答:在直播中分享的案例中(如下圖),這個案例當時沒有單獨拿GMP批次樣品再次做動物實驗。因為毒理批次已經(jīng)完成了動物實驗,雖然在安全性實驗中,雜質含量只有0.18%,我們按照毒理批次雜質的含量,結合動物實驗NOAEL值去計算臨床批可接受限度大于0.3%,所以GMP產(chǎn)品是安全的,就不需要再單獨拿GMP批次進行動物實驗了。
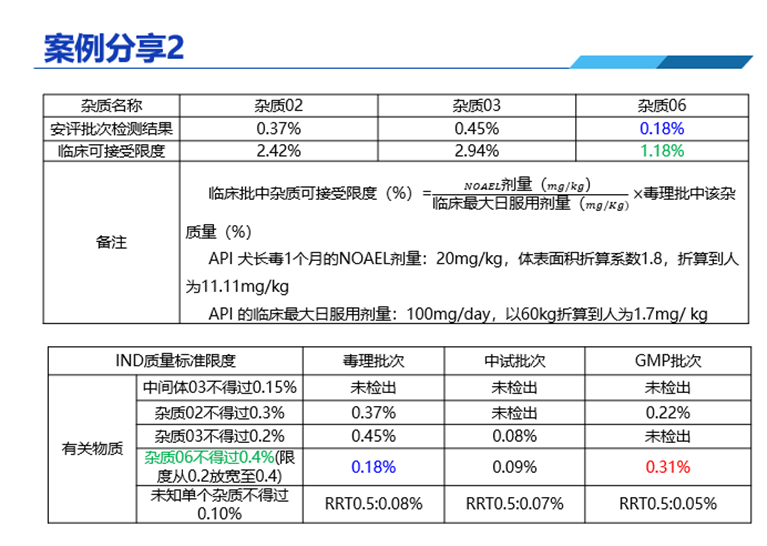
問:重金屬限度研究要在哪個階段開始?
答:在一開始定質量標準檢測時,就定入。有代表批次樣品時,如小試批次時,就可以開始研究檢測。
關于新藥研發(fā)的質量學研究方面,您還有什么困惑和感興趣的話題嗎?歡迎留言評論。
美迪西分析測試服務中心位于美迪西南匯園區(qū),實驗室總面積達2800+平方米,GMP體系多次通過NMPA現(xiàn)場核查,并積極推進CNAS認證。
目前,美迪西分析測試服務中心搭建了基因毒性研究、理化表征研究、微生物研究、雜質制備及結構鑒定、痕量雜質殘留溶劑分析、痕量雜質元素雜質分析、安全評估試驗、分析方法開發(fā)及質量監(jiān)控等服務平臺,可為客戶提供一體化的藥物分析解決方案和技術服務,包括常規(guī)理化檢測項目、特殊檢測項目、色譜檢測項目等,支持新藥開發(fā)、藥品CMC申報以及生產(chǎn)放行等,助力新藥上市及國際化進程。