



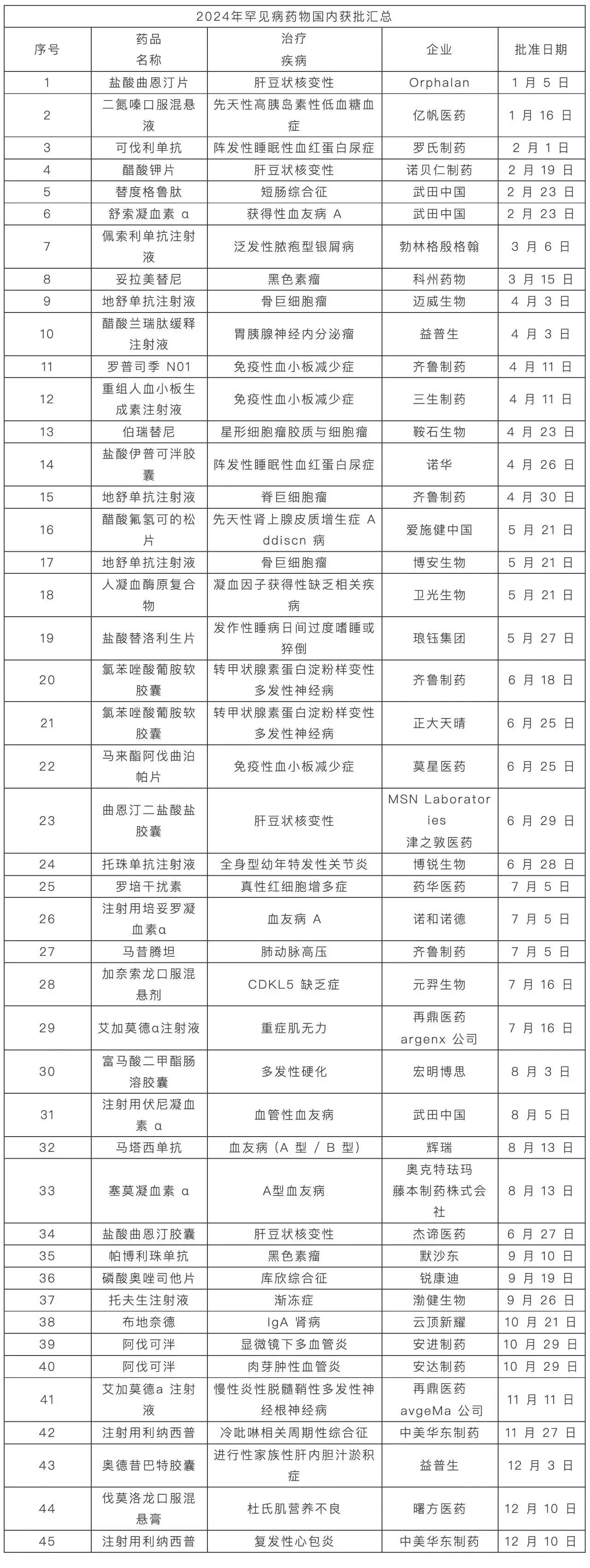
業(yè)務(wù)咨詢
中國:
Email: marketing@medicilon.com.cn
業(yè)務(wù)咨詢專線:400-780-8018
(僅限服務(wù)咨詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




2月28日是第18個國際罕見病日,今年的主題是“More than you can imagine”,意為“不止罕見”。孤兒藥作為治療罕見病的希望之光,逐漸成為全球醫(yī)藥行業(yè)的熱點領(lǐng)域,具有哪些市場逆襲邏輯呢?

未滿足的醫(yī)療需求:罕見病治療的使命與挑戰(zhàn)
世界衛(wèi)生組織(World Health Organization,WHO)將罕見病定義為患病人群占總?cè)丝?.65%~1.00%的疾病[?1]。在我國,中華醫(yī)學會遺傳學分會則將患病率低于1/50萬或新生兒的發(fā)病率低于1/1萬的疾病定義為罕見病[?2]。目前全球已知的罕見病種類超過7000種[3]。根據(jù)歐洲Orphanet數(shù)據(jù)庫,截至2024年4月10日,已登記了6313種罕見病的相關(guān)信息[4],在全球范圍內(nèi),罕見病患者總數(shù)更是多達3.5億[5]。中國有超過2000萬罕見病患者,且每年新增患者超過20萬[1]。

當前,罕見病治療領(lǐng)域面臨著嚴峻挑戰(zhàn),僅有不到10%擁有有效的治療方案,兒童患者占比高達50%,給家庭和社會帶來了的負擔增長速度幾乎呈幾何級數(shù)。以脊髓性肌萎縮癥(SMA)為例,患者的年均醫(yī)療支出超過百萬元,倒逼社會對孤兒藥的剛性需求?。
更深層的矛盾在于,罕見病治療呈現(xiàn)“長尾效應(yīng)”——單病種患者數(shù)量少,但疾病種類龐大?。這種碎片化需求與集中化供給的矛盾,為孤兒藥市場創(chuàng)造結(jié)構(gòu)性增長空間。
萬億市場潛力:罕見病藥成全球藥企的焦點
由于單一罕見病患者數(shù)量相對較少,病情復雜、診斷困難,以及罕見病藥研發(fā)過程中面臨患者入組困難和終點指標復雜等挑戰(zhàn)[1],導致罕見病藥的開發(fā)過程復雜、成本高昂、成功率極低[6]。
然而,一旦研發(fā)成功,罕見病藥所能帶來的回報往往是極為可觀的。根據(jù)財報,福泰制藥(Vertex)的Trikafta作為治療罕見病囊性纖維化(CF)的特效藥,2024年前三季度銷售額累計達75.2億美元,同比增長14%;羅氏用于治療復發(fā)緩解型(RRMS)和原發(fā)進展型(PPMS)兩種多發(fā)性硬化癥類型的藥物Ocrevus在2024年創(chuàng)收67.44億瑞士法郎(約76.80億美元),同比增長9%;百濟神州針對慢性淋巴細胞白血病和小淋巴細胞淋巴瘤的藥物澤布替尼(BTK抑制劑)2024年前三季度全球銷售額達129.32億元,美國市場占比73%;長春金賽藥業(yè)針對罕見病特納綜合癥所致女孩生長障礙的重組人生長激素注射液,在2020年-2024年的單品銷售額突破160億,連續(xù)3年保持增長……
高額的回報,吸引著多家跨國制藥企業(yè)將目光投向這一領(lǐng)域。例如,強生斥資300億美元收購了瑞士罕見病藥物研發(fā)企業(yè)愛可泰隆[7],武田則以620億美元的高價并購了英國罕見病藥物研發(fā)企業(yè)夏爾[8]。此外,阿斯利康以390億美元收購了亞力兄制藥[9],安進也花費283億美元收購了Horizon Therapeutics[10]。
據(jù)Evaluate Pharma數(shù)據(jù)庫預測,到2028年,全球罕見病市場規(guī)模將達到3000億美元,占全球處方藥市場規(guī)模的20%[11],市場潛力可見。
創(chuàng)新技術(shù)革命:從基因藥到AI賦能的范式突破
罕見病治療領(lǐng)域,傳統(tǒng)方法一直側(cè)重于小分子藥物的探索,但隨著科研技術(shù)的發(fā)展,靶向治療藥物也逐漸成為可能,包括基于蛋白質(zhì)的治療方法(蛋白質(zhì)、肽和抗體)、反義寡核苷酸、小干擾RNA,以及基因和細胞療法[12]。
CRISPR基因編輯技術(shù)的成熟,使單基因罕見病治療成為可能。2024年獲批的β-地中海貧血基因療法Lyfgenia,通過體外編輯患者造血干細胞,治愈率超90%,單次治療定價高達280萬美元?。
小核酸藥物則通過靶向mRNA實現(xiàn)了對疾病根源的治療。例如,蔡磊團隊參與的漸凍癥藥物RAG-21,利用RNA干擾技術(shù)沉默致病基因SOD1,臨床前數(shù)據(jù)顯示可減少80%的毒性蛋白沉積,目前已進入Ⅰ期臨床試驗階段。
此外,AI也在罕見病藥研發(fā)領(lǐng)域展現(xiàn)出了巨大的潛力。來自哈佛醫(yī)學院的研究團隊及其合作者開發(fā)了TxGNN AI模型,已篩選出17000多種疾病的潛在藥物,識別能力提升近50%,禁忌癥預測準確率提高35%[13]。
政策激勵體系:構(gòu)建商業(yè)“護城河”
全球罕見病藥立法框架已形成“政策激勵-專利保護-市場獨占”的完整閉環(huán)。為了促進罕見病藥的研發(fā)和創(chuàng)新,各國政府紛紛出臺相關(guān)政策。美國是最早對罕見病藥研發(fā)和創(chuàng)新提供政策保障的國家[14]。2017年,美國食品藥品監(jiān)督管理局(FDA)頒布了《FDA孤兒藥現(xiàn)代化計劃》,提出了孤兒藥認定申請需在90天內(nèi)完成審查的要求[15]。
近年來,我國也陸續(xù)出臺了多項促進罕見病藥物研發(fā)和注冊的相關(guān)政策[16],如通過制定罕見病目錄、實施優(yōu)先審評審批政策以及提供市場獨占期(最長可達7年)等措施,在地方層面,浙江、江蘇等地已設(shè)立專項基金。這些都促進了罕見病藥物市場的發(fā)展。
商業(yè)模式創(chuàng)新:從“高價壟斷”到“價值醫(yī)療”
在中國,政府正在探索“省級罕見病專項基金+商業(yè)保險”的支付模式,截至2024年8月,中國已有207種罕見病納入國家目錄,其中165種藥物獲批上市,覆蓋92種疾病,并通過談判降低價格。而跨國藥企正在采用“靈活付費”的商業(yè)模式來解決支付難題。例如,諾華Zolgensma采用“分期支付+療效掛鉤”的方式,降低支付壓力。歐盟則試點了“跨國費用共擔機制”,讓多個國家共同分攤治療費用,以降低個別支付方的負擔。

此外,“一藥多效”策略也在罕見病藥領(lǐng)域得到了廣泛應(yīng)用,如依庫珠單抗(eculizumab)能治療4種罕見病,為藥企創(chuàng)造可持續(xù)回報。
自救與群救:從患者到產(chǎn)業(yè)共建者的角色蛻變
當蔡磊用漸凍之軀搭建全球最大的漸凍癥患者大數(shù)據(jù)平臺;當門克斯病患兒家屬自學制藥研發(fā)基因藥物;大皰性表皮松解癥患兒家屬創(chuàng)建公益組織“上海德博蝴蝶寶貝關(guān)愛中心”,這些患者群體及其家屬,已從“被動等待”化身為“主動創(chuàng)造”。病痛挑戰(zhàn)基金會發(fā)布的《患者參與指南》,更是為患者代表打開了臨床試驗設(shè)計委員會的大門,成為重塑研發(fā)邏輯的關(guān)鍵力量。

美迪西一站式服務(wù)平臺:助力罕見病藥物研發(fā)
作為專業(yè)的生物醫(yī)藥研發(fā)服務(wù)平臺,美迪西在罕見病藥物研發(fā)領(lǐng)域展現(xiàn)出了強大的服務(wù)能力。公司擁有一支經(jīng)驗豐富、專業(yè)素質(zhì)過硬的科研團隊,可提供藥物發(fā)現(xiàn)、藥學、藥效、藥代、安評等一站式臨床前研發(fā)服務(wù)。在核酸藥物研發(fā)服務(wù)方面,美迪西能夠提供從核酸序列設(shè)計與優(yōu)化、載體構(gòu)建、工藝開發(fā)、質(zhì)量研究以及臨床前研究等一站式解決方案。
依托一站式生物醫(yī)藥臨床前研發(fā)服務(wù)平臺,美迪西已成功助力多款罕見病藥物獲批臨床,如,美迪西為璧辰醫(yī)藥用于治療攜帶BRAF V600突變的腦膠質(zhì)母細胞瘤的ABM-1310提供了藥物發(fā)現(xiàn)服務(wù);為廣州喜鵲醫(yī)藥用于治療特發(fā)性肺動脈高壓(IPAH)的MN-08提供了原料藥工藝開發(fā)及質(zhì)量研究等服務(wù);為用于治療結(jié)節(jié)病的KBMAB-16為供了符合中美要求的長期毒性試驗服務(wù)……這些IND項目為美迪西賦能罕見病藥物研發(fā)積累了寶貴經(jīng)驗。
每一個生命都值得被尊重,每一種疾病都值得被治愈。美迪西愿與各界攜手共研,為罕見病藥物研發(fā)貢獻力量,為那些被罕見病困擾的生命帶來希望的曙光,讓每一個生命都能在科學的照耀下綻放光彩。
參考文獻:
[1]Wu XF,Xu W,Yu MY,et al. Clinical trials of orphan drugs in China over the decade 2012-2022:opportunities and challenges[J]. Pharmacol Res,2022,182:106349.
[2]胡善聯(lián). 國內(nèi)外罕見病的保障政策研究[J].衛(wèi)生經(jīng)濟研究,2018 (5):3-5. Hu SL. Research on the health security policy of rare diseases at home and abroad[J]. Health Econ Res,2018(5):3-5.
[3]Chan AYL, Chan VKY, Olsson S, et al. Access and unmet needs of orphan drugs in 194 countries and 6 areas: a global oolicy review with content analysis[J]. Value Health, 2020, 23(12): 1580-1591.
[4]Orphanet.Knowledge on rare diseases and orphan drugs[EB/OL].(2024-04-10)[2024-04-10]. https://www.orpha.net/#menu.
[5]Attwood MM,Rask-Andersen M,Schi?th HB. Orphan drugs and their impact on pharmaceutical development[J]. Trends Pharmacol Sci,2018,39(6):525-535.
[6]Pogue RE,Cavalcanti DP,Shanker S,et al. Rare genetic diseases:update on diagnosis,treatment and online resources[J]. Drug Discov Today,2018,23(1):187-195.
[7]Johnson & Johnson.Johnson & Johnson to acquire actelion for $30 billion with spin-out of new R&D company [EB/OL].[2023-08-22].https://www.jnj.com/mediacenter/press-releases/johnson-johnson-to-acquire-actelion.
[8]THE WALL STREET JOURNAL.At Takeda, M&A integration on a global fast track [EB/OL].(2021-12-11)[2023-08-22].https://deloitte.wsj.com/articles/at-takeda-ma-integration-on-a-global-fast-track-01639165761.
[9] AstraZeneca.AstraZeneca to acquire Alexion, accelerating the company’s strategic and financial development [EB/OL].(2020-12-12)[2023-08-22].ht t p s : / /www.a(chǎn)strazeneca.com/media-centre/press-releases/2020/astrazeneca-to-acquire-alexion.html#!.
[10]AMGEN.Rule 2.7 announcement: amgen inc to acquire horizon therapeutics plc[EB/OL].(2022-12-12)[2023-08-22].https://www.a(chǎn)mgen.com/newsroom/pressreleases/2022/12/rule-2-7-announcement-amgen-inc-toacquire-horizon-therapeutics-plc.
[11]SENIOR M, HADJIVASILIOU A.Orphan drug report 2022 [EB/OL].(2022-04-27)[2023-07-29].https://www.evaluate.com/thought-leadership/pharma/orphan-drug-2022-report.
[12]Tambuyzer E,Vandendriessche B,Austin CP,et al. Therapies for rare diseases:therapeutic modalities,progress and challenges ahead[J]. Nat Rev Drug Discov,2020,19(2):93-111.
[13]Huang, K., Chandak, P., Wang, Q. et al. A foundation model for clinician-centered drug repurposing. Nat Med (2024). https://doi.org/10.1038/s41591-024-03233-x
[14]黃方如, 邵文斌.中國罕見病藥物可及性報告2019 [EB/OL].(2019-02-28)[2023-07-29].https://www.iqvia.com/zh-cn/locations/china/library/brochures/viewpointissue-42.
[15]王 雪, 劉麗華, 張 綺, 等.淺析美國罕見病治療藥物激勵政策發(fā)展及對我國的啟示[J].中國臨床藥理學雜志,2020, 36(12): 1768-1772.
[16]YANG Y, KANG Q, HU J, et al.Accessibility of drugs for rare diseases in China: policies and current situation [J].Intractable Rare Dis Res, 2019, 8(2): 80-88.
 相關(guān)新聞
相關(guān)新聞