抗體藥物偶聯(lián)物(ADC)是近年來腫瘤治療研究的焦點(diǎn),因其良好的靶向性和明顯的臨床療效成為抗體藥物研發(fā)的前沿,是我國新藥研發(fā)的戰(zhàn)略重點(diǎn)之一。但國內(nèi)能提供ADC藥物的整套藥代和安全性評價(jià)服務(wù)并通過NMPA技術(shù)審評的CRO公司并不多。
美迪西在ADC的臨床前研究方面擁有專業(yè)的技術(shù)團(tuán)隊(duì)和豐富的項(xiàng)目研究經(jīng)驗(yàn),可為客戶提供一整套的臨床前服務(wù)。ADC藥物組成相對復(fù)雜,為降低研發(fā)風(fēng)險(xiǎn),美迪西有責(zé)任并且也希望有機(jī)會(huì)與醫(yī)藥界同仁攜手推動(dòng)靶向治療藥物的發(fā)展。
抗體藥物偶聯(lián)物(ADC)是一種將高選擇性的抗體和強(qiáng)細(xì)胞毒性的Payloads通過Linker偶聯(lián)而獲得的藥物。ADC Payloads通常是有效的抗有絲分裂細(xì)胞毒素或DNA 烷化劑或具有其他細(xì)胞殺傷機(jī)制的試劑。ADC結(jié)合了單抗對腫瘤細(xì)胞的靶向性以及細(xì)胞毒性藥物的強(qiáng)大腫瘤殺傷力,且克服了單抗的細(xì)胞毒性弱和細(xì)胞毒性藥物系統(tǒng)毒性大的問題,具有1+1>2的治療優(yōu)勢。
ADC藥物發(fā)展史
1906年,首次提出 ”Magic Bullet“ 靶向治療概念;
1967年,ADC概念首次被提出;
1972年,用非共價(jià)偶聯(lián)的ADC進(jìn)行動(dòng)物試驗(yàn);
1975年,用共價(jià)偶聯(lián)的ADC進(jìn)行動(dòng)物試驗(yàn);
1983年,首款A(yù)DC藥物進(jìn)行臨床試驗(yàn)階段;
1993年,BR96-Doxorubicin conjugate (BMS-182248) 在人腫瘤異種移植物小鼠模型中實(shí)現(xiàn)治愈;
2009年,Mylotarg (Pfizer) 成為首款獲批的ADC藥物;
2010年,Mylotarg 從美國撤市;
2011年, Adcetris (Takeda) 獲FDA批準(zhǔn);
2013年,Kadcyla (Roche) 獲FDA批準(zhǔn);
2017年,Besponsa (Pfizer) 獲FDA批準(zhǔn);
2017年,Mylotarg (Pfizer) 重新上市;
2019年,Polivy (Roche)、Padcev (Seagen 和Astellas) 、Enhertu (第一三共和AstraZeneca)三款A(yù)DC藥物相繼獲得FDA批準(zhǔn);
2020年,Trodelvy (Gilead)、Blenrep (GSK) 獲FDA批準(zhǔn);
2021年,Zynlonta (ADC Therapeutics)、愛地希 (榮昌生物) 獲批......
鑒于Payloads、Linker和偶聯(lián)方法的改進(jìn),ADC的開發(fā)在過去十年中取得了顯著進(jìn)展。特別是,Linker的設(shè)計(jì)對調(diào)節(jié) ADC 在體循環(huán)中的穩(wěn)定性和腫瘤中的Payloads釋放效率方面起著關(guān)鍵作用,從而影響 ADC 的
藥代動(dòng)力學(xué) (PK)、藥效和毒性特征。
迄今為止,F(xiàn)DA已批準(zhǔn)了十多種ADC藥物。尤其,近幾年批準(zhǔn)的 Zynlonta、Trodelvy、Polivy、Enhertu、Adcetris、Kadtanstuzine和 Besponsa正不斷擴(kuò)大 ADC 的應(yīng)用范圍。
所以,ADC藥物市場真可謂臥虎藏龍,法國圖爾大學(xué)2020年在《Nature Reviews Drug Discovery》發(fā)表文章預(yù)測2026年ADC藥物的銷售額將超過164億美元。其中包括5款重磅藥物Enhertu,Padcev,Kadcyla,Adcetris,Trodelvy。
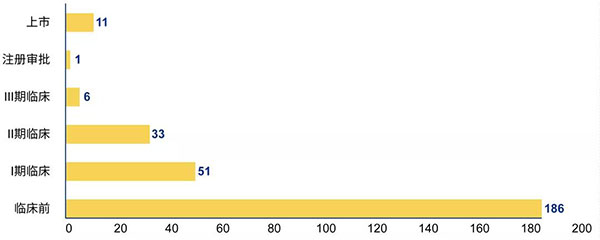
全球在研及上市ADC藥物研發(fā)階段
國內(nèi)藥企緊隨ADC行業(yè)熱潮
國內(nèi)ADC藥物研發(fā)熱情高漲,“群雄逐鹿”。早期布局ADC藥物的多為技術(shù)平臺(tái)型公司,例如榮昌生物、多禧生物、百奧泰、樂普生物等。
榮昌生物開發(fā)的RC48是中國最早進(jìn)入臨床研究的國產(chǎn)ADC藥物之一。RC48以腫瘤表面的HER2蛋白為靶點(diǎn),能精準(zhǔn)識(shí)別癌細(xì)胞并與之結(jié)合,穿透細(xì)胞膜進(jìn)入其內(nèi)部,從而殺死癌細(xì)胞。
多禧生物是國內(nèi)ADC產(chǎn)品布局最多的企業(yè)之一,目前擁有20多條ADC研發(fā)管線。多禧生物不斷引進(jìn)先進(jìn)平臺(tái),致力于打造完整ADC研發(fā)生產(chǎn)鏈條,引進(jìn)了一大批先進(jìn)歐美研發(fā)、檢驗(yàn)和中試生產(chǎn)設(shè)備,建立了完善研發(fā)和中試平臺(tái)。具有獨(dú)立從事ADC藥物研發(fā)與生產(chǎn)的能力。
DAC-002正在開展HER2陽性晚期乳腺癌和/或胃癌、晚期實(shí)體瘤的I期臨床試驗(yàn),其中DAC-002的臨床進(jìn)度在國內(nèi)TROP-2 ADC藥物內(nèi)處于領(lǐng)先地位。Trop2(人滋養(yǎng)層細(xì)胞表面糖蛋白抗原 2)是由Tacstd2 基因編碼的跨膜糖蛋白,在許多癌癥中出現(xiàn)差異表達(dá)。Trop2 通過不同的途徑向細(xì)胞發(fā)出信號(hào),受多種轉(zhuǎn)錄因子的調(diào)控。Trop2會(huì)向細(xì)胞發(fā)出自我更新、增殖、侵襲等信號(hào),具有類似干細(xì)胞的特性。Trop2 在許多正常組織中表達(dá),但相比之下,它在許多癌癥中過度表達(dá),且 Trop2 的過度表達(dá)具有預(yù)后意義。Trop2 在癌細(xì)胞中的表達(dá)與耐藥性相關(guān)。因此以Trop2為靶點(diǎn)的抗腫瘤藥物研究具有重要意義,目前以Trop2為靶點(diǎn)的抗體、抗體偶聯(lián)物以及聯(lián)合用藥等多種形式的藥物正處于研發(fā)中。
其中,美迪西在多禧生物ADC藥物
DAC-002的研究中,完成了臨床前的藥代和毒理學(xué)研究,加速了研發(fā)進(jìn)程。DAC-002是抗Trop2單抗通過智能連接體偶聯(lián)抗微管蛋白Tubulysin B類似物的ADC藥物,用于治療Trop2三陰性乳腺癌、小細(xì)胞肺癌、非小細(xì)胞肺癌、胰腺癌。
另外,MUC1 ADC是國內(nèi)首款靶向Muc1的ADC藥物,2021年4月初,多禧生物申報(bào)的“注射用重組人源化抗MUC1單抗-Tub201偶聯(lián)劑“臨床試驗(yàn)申請獲受理,現(xiàn)已經(jīng)獲得臨床許可。其中,美迪西在
Muc1新藥研發(fā)中,提供了包括藥效、藥代及安全評價(jià)等全套臨床前研究服務(wù),助力項(xiàng)目成功獲批臨床。

多禧生物部分研發(fā)管線(圖片來源:多禧生物官網(wǎng))
此外,樂普生物等也有多款A(yù)DC藥物處于臨床階段。樂普生物致力于開發(fā)ADC產(chǎn)品。根據(jù)Frost & Sullivan資料顯示,按臨床階段ADC候選藥物的數(shù)量統(tǒng)計(jì),樂普生物的ADC候選藥物管線在中國處于領(lǐng)先地位。
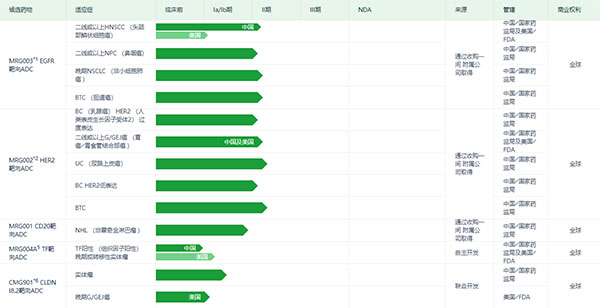
樂普生物ADC產(chǎn)品研發(fā)管線(圖片來源:樂普生物官網(wǎng))
一站式CXO服務(wù)
國內(nèi)ADC藥物CXO服務(wù)需求旺盛,供給側(cè)競爭格局初成。根據(jù)Roots Analysis,目前超過70%的ADC藥物生產(chǎn)被外包,全球范圍只有不到50家CMO企業(yè)能提供ADC定制生產(chǎn)或/和偶聯(lián)服務(wù)。其中只有十幾家企業(yè)能提供一站式CDMO服務(wù),具有供應(yīng)鏈集成優(yōu)勢,各企業(yè)也紛紛通過投資和戰(zhàn)略合作來拓展服務(wù)范圍。
全球有約250項(xiàng)處于不同研發(fā)階段的ADC候選藥物,未來十年CMO/CDMO市場預(yù)期將保持快速增長。
美迪西專注于ADC一站式非臨床研究服務(wù),包括Payloads合成、藥效學(xué)評價(jià)、藥代動(dòng)力學(xué)評價(jià)和安全性評價(jià)等服務(wù),其中多套項(xiàng)目獲批IND。
美迪西擁有符合國際標(biāo)準(zhǔn)的新藥安全性評價(jià)研究、同位素藥物代謝研究及腫瘤藥效研究三大研究平臺(tái),可一站式完成ADC藥物臨床前藥效學(xué)、藥代動(dòng)力學(xué)及安全性評價(jià)研究等服務(wù)。
藥效學(xué)評價(jià):
為客戶提供成熟的評估ADC體內(nèi)藥效的腫瘤模型,包括多種腫瘤類型,多種建模方法,多種屬模式生物;并以GLP-like的高標(biāo)準(zhǔn)完成相關(guān)評價(jià)工作。
藥代動(dòng)力學(xué)評價(jià):
在ADC藥物的體內(nèi)分析中為多種目標(biāo)分析物質(zhì)提供了高質(zhì)量的測試方法,為客戶提供可靠優(yōu)質(zhì)的PK數(shù)據(jù)。
安全性評價(jià):
遵循ICH指導(dǎo)原則S6和S9,結(jié)合具體項(xiàng)目定制個(gè)性化的安全性評價(jià)方案,提供符合NMPA,F(xiàn)DA,TGA等國際GLP標(biāo)準(zhǔn)的安全性評價(jià)服務(wù),包括:單次和重復(fù)給藥毒性試驗(yàn)(伴隨毒代動(dòng)力學(xué)研究)、安全藥理、免疫原性檢測。
美迪西可提供ADC Payloads合成服務(wù),有多種不同作用機(jī)制的化學(xué)Payloads分子供客戶備選,同時(shí)可以定制合成客戶所需的一種或幾種Payload。公司還可以提供全程項(xiàng)目管理,藥品開發(fā)和注冊策略咨詢以及基于NMPA/FDA的IND申報(bào)資料的編制報(bào)批服務(wù)。
美迪西ADC臨床前研發(fā)解決方案
ADC藥物的研究沒有固定的研究方案,由于偶聯(lián)方式、藥物結(jié)構(gòu)的差異化,每個(gè)ADC藥物的臨床前研究都存在著不同的挑戰(zhàn)和難題。美迪西在ADC的臨床前一體化研究方案制定中與客戶深入交流,科研骨干將每一個(gè)案例的特點(diǎn)與多年實(shí)戰(zhàn)經(jīng)驗(yàn)和技術(shù)積累相結(jié)合,謹(jǐn)慎地將優(yōu)質(zhì)實(shí)驗(yàn)方案與結(jié)果提交到客戶手上。
美迪西在ADC藥物臨床前藥效學(xué)、藥物動(dòng)力學(xué)及安全性評價(jià)研究領(lǐng)域已積累了深厚的理論基礎(chǔ)和豐富的實(shí)踐經(jīng)驗(yàn)。截至目前,美迪西已完成8套整體臨床前研究項(xiàng)目。其中,6套已獲得NMPA IND批件,1套已獲NMPA&FDA雙許可,并有多個(gè)ADC項(xiàng)目在研。
隨著更多創(chuàng)新療法的出現(xiàn),期望ADC的將來更安全、更有效,更精準(zhǔn)靶向,為更多難治性疾病患者帶來更多的希望。
參考文獻(xiàn)
[1] P A Trail, et al. Cure of xenografted human carcinomas by BR96-doxorubicin immunoconjugates. Science. 1993 Jul 9;261(5118):212-5. https://pubmed.ncbi.nlm.nih.gov/8327892
[2] Anna Shvartsur, et al. Trop2 and itsoverexpression in cancers: regulation and clinical/therapeutic implications. Genes Cancer. 2015Mar;6(3-4):84-105. https://pubmed.ncbi.nlm.nih.gov/26000093/
[3] Dian Su, et al. Linker Design Impacts Antibody-Drug Conjugate Pharmacokinetics and Efficacy via Modulating the Stability and Payload Release Efficiency. Front Pharmacol. 2021 Jun 23;12:687926. https://pubmed.ncbi.nlm.nih.gov/34248637/
聯(lián)系我們:
電話: +86 (21) 5859-1500(總機(jī))











 相關(guān)新聞
相關(guān)新聞