



業(yè)務(wù)咨詢
中國(guó):
Email: marketing@medicilon.com.cn
業(yè)務(wù)咨詢專線:400-780-8018
(僅限服務(wù)咨詢,其他事宜請(qǐng)撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




英國(guó)哲學(xué)家席勒曾寫到
... ...
時(shí)間步伐有三種
未來(lái)姍姍來(lái)遲
現(xiàn)在像箭一般飛逝過(guò)去
永遠(yuǎn)靜止不動(dòng)
... ...
我們乘著流動(dòng)的時(shí)間
見(jiàn)證知識(shí)、技術(shù)、革新
不斷為人類健康帶來(lái)新的影響
[點(diǎn)擊 關(guān)鍵詞 穿梭2023年
2023年1月6日,F(xiàn)DA加速批準(zhǔn)了渤健/衛(wèi)材的lecanemab(Leqembi)上市申請(qǐng),用于治療阿爾茨海默病(AD),這預(yù)示著多年頗為沉寂的AD市場(chǎng)迎來(lái)有希望的發(fā)展。這款抗β淀粉樣蛋白(Aβ)單克隆抗體,能夠選擇性結(jié)合以中和消除可溶性、有毒的淀粉樣蛋白-β(Aβ)聚集體(原纖維),而這些聚集體被認(rèn)為有助于AD中的神經(jīng)退行性過(guò)程。
至7月6日,F(xiàn)DA官網(wǎng)顯示Leqembi的加速批準(zhǔn)已成功轉(zhuǎn)為完全批準(zhǔn)。
FDA藥品評(píng)價(jià)與研究中心(CDER)主任Billy Dunn博士表示:“阿爾茨海默癥極大影響了患者的生活,對(duì)他們所愛(ài)的人也產(chǎn)生了毀滅性影響。Lecanemab是針對(duì)和影響這種疾病過(guò)程的最新療法,而不是只治療相關(guān)癥狀。”
? 助力中國(guó)原創(chuàng)阿爾茨海默癥新藥GV-971上市
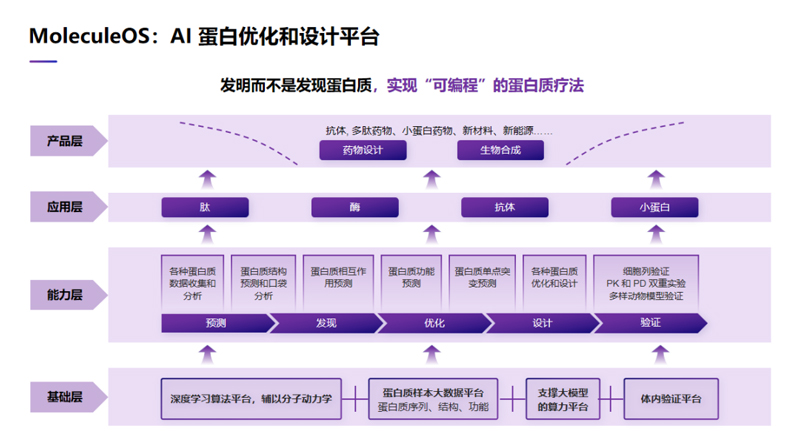
2023年1月11日,在機(jī)器之心AI科技年會(huì)上,分子之心創(chuàng)始人、美國(guó)芝加哥豐田計(jì)算技術(shù)研究所終身教授、清華大學(xué)智能產(chǎn)業(yè)研究院(AIR)卓越訪問(wèn)教授許錦波發(fā)表主題演講《AI蛋白質(zhì)設(shè)計(jì)最新進(jìn)展》,分享了分子之心開(kāi)發(fā)的AI蛋白優(yōu)化和設(shè)計(jì)平臺(tái)——MoleculeOS,以及在蛋白質(zhì)側(cè)鏈、抗體抗原復(fù)合物結(jié)構(gòu)預(yù)測(cè)的最新研究成果。
許錦波教授在演講最后總結(jié)道:“人工智能不但顛覆了蛋白質(zhì)結(jié)構(gòu)預(yù)測(cè),其實(shí)也大幅度地提高了蛋白質(zhì)其他方面的研究的性能。比如在蛋白質(zhì)側(cè)鏈結(jié)構(gòu)預(yù)測(cè),在蛋白質(zhì)復(fù)合物,特別是抗體抗原復(fù)合物結(jié)構(gòu)預(yù)測(cè)方面,在蛋白質(zhì)的優(yōu)化和設(shè)計(jì)方面,通過(guò)使用人工智能,我們都可以做得比傳統(tǒng)方法要好很多。”

2023年3月13日,輝瑞宣布以430億美元收購(gòu)抗體偶聯(lián)藥物(ADC)企業(yè)Seagen,以加強(qiáng)其癌癥治療項(xiàng)目。
Seagen已有4款獲批的藥物,其中3款為ADC藥物,1款為小分子藥物。
?PADCEV:Enfortumab vedotin-ejfv,靶向Nectin-4 ADC,適應(yīng)癥為轉(zhuǎn)移性尿路上皮癌(mUC)。2023年12月15日,F(xiàn)DA提前批準(zhǔn)了PADCEV聯(lián)合K藥(默沙東)用于一線治療局部晚期或轉(zhuǎn)移性尿路上皮癌(la/mUC)成人患者治療,比PDUFA的目標(biāo)日期(2024年5月9日)提前了將近五個(gè)月。
?ADCETRIS:維布妥昔單抗,是一款靶向CD30 ADC,適應(yīng)癥為霍奇金淋巴瘤和系統(tǒng)性間變性大細(xì)胞淋巴瘤等。
?TIVDAK:tisotumab vedotin-tftv,靶向TF ADC,適應(yīng)癥為化療期間或之后出現(xiàn)疾病進(jìn)展的復(fù)發(fā)或轉(zhuǎn)移性宮頸癌成人患者。
?TUKYSA:圖卡替尼Tucatinib,是一種口服小分子HER2蛋白的酪氨酸激酶抑制劑,適應(yīng)癥為HER2陽(yáng)性不可切除、轉(zhuǎn)移性乳腺癌。
此外,同年12月15日,和鉑醫(yī)藥子公司諾納生物將MSLN ADC新藥HBM9033的全球權(quán)益授權(quán)給Seagen。
?HBM9033(H2L2-ADC)是一款潛在BIC產(chǎn)品,特異性靶向人間皮素(MSLN),同年8月已獲FDA批準(zhǔn)進(jìn)行臨床試驗(yàn),用于治療晚期實(shí)體瘤。
? 助力安諦康生物兒童版“一粒治愈”流感新藥在中國(guó)臨床受理
? 助力軒竹生物研發(fā)的完全敲除巖藻糖的雙抗ADC藥物KM501獲批臨床
? 美迪西抗體藥物偶聯(lián)物(ADC)研發(fā)服務(wù)平臺(tái)

2023年4月30日,安斯泰來(lái)與眼科公司Iveric Bio達(dá)成協(xié)議,以59億美元收購(gòu)后者,擴(kuò)展在眼科療法領(lǐng)域的布局。
Iveric Bio是一家專注于眼科療法開(kāi)發(fā)的生物制藥公司,研發(fā)管線包括核酸適配體(Aptamer)和AAV基因療法,致力于研發(fā)視網(wǎng)膜疾病的新型治療方案。2023年2月已宣布美國(guó)FDA受理了其首發(fā)管線Avacincaptad Pegol的新藥申請(qǐng),這款新型補(bǔ)體蛋白C5抑制劑用于治療年齡相關(guān)性黃斑變性(AMD)繼發(fā)的地圖樣萎縮(GA)。該管線獲FDA優(yōu)先審評(píng)和突破性療法雙重資格。
至8月5日,安斯泰來(lái)宣布FDA批準(zhǔn)了Avacincaptad Pegol上市,商品名為IZERVAY?。
? 助力銳明新藥國(guó)內(nèi)首創(chuàng)治療wAMD滴眼劑I期臨床結(jié)果積極
? 美迪西與艾爾康生物達(dá)成戰(zhàn)略合作,助力眼科細(xì)胞和基因藥物臨床前研發(fā)

2023年6月3日,諾和諾德司美格魯肽注射液(GLP-1受體激動(dòng)劑)上市申請(qǐng)正式獲國(guó)家藥監(jiān)局受理,申報(bào)適應(yīng)癥或?yàn)闇p重適應(yīng)癥。2021年4月,司美格魯肽已在中國(guó)內(nèi)地獲批降糖適應(yīng)癥,如此次獲批上市,諾和諾德的司美格魯將成為首款進(jìn)口減肥藥。
知名學(xué)術(shù)期刊《科學(xué)》也將胰高血糖素樣肽-1(GLP-1)激動(dòng)劑評(píng)為2023年度科學(xué)突破(Science’s 2023 Breakthrough of the Year),這標(biāo)志著在對(duì)抗肥胖癥及其相關(guān)并發(fā)癥的長(zhǎng)期斗爭(zhēng)中的重要里程碑。這項(xiàng)科學(xué)成就不僅在肥胖癥治療領(lǐng)域產(chǎn)生了深遠(yuǎn)影響,而且其潛在應(yīng)用正被廣泛研究,包括在治療藥物成癮和神經(jīng)退行性疾病等多種病癥方面的用途。
? 助力德睿智藥GLP-1RA小分子口服藥物成功完成臨床I期首例受試者給藥
? 美迪西“GLP-1”新藥研發(fā)服務(wù)能力介紹
2023年7月17日,BridgeBio Pharma宣布其核心產(chǎn)品Acoramidis治療轉(zhuǎn)甲狀腺素蛋白淀粉樣變心肌病(ATTR-CM)的三期臨床獲得成功。
受此消息影響,BridgeBio Pharma股價(jià)盤前大漲64%,市值超過(guò)50億美元。
Acoramidis(AG10)是具有口服活性的、選擇性的甲狀腺素轉(zhuǎn)運(yùn)蛋白(TTR)的穩(wěn)定劑,對(duì)野生型和V1221突變型均有效。
ATTR-CM是一種罕見(jiàn)、致死性疾病,由于疾病認(rèn)知度低、臨床癥狀缺乏特異性,常被誤診為原因不明性心力衰竭或肥厚型心肌病,造成患者診斷和治療延誤。
? 助力璧辰醫(yī)藥ABM-1310獲美國(guó)FDA孤兒藥資格認(rèn)證,用于治療攜帶BRAF V600突變的腦膠質(zhì)母細(xì)胞瘤患者

2023年8月4日,Sage Therapeutics和Biogen共同開(kāi)發(fā)的重磅新藥Zurzuvae獲FDA批準(zhǔn),用于治療成人產(chǎn)后抑郁癥(PPD)。Zurzuvae是首款也是唯一一款可快速改善PPD女性抑郁癥狀的口服藥物,只需每天口服一次,療程14天,完成療程后仍能保持效果,無(wú)需繼續(xù)服用藥物。這種不同于傳統(tǒng)長(zhǎng)期服藥的抑郁癥治療模式能夠規(guī)避慢性副作用。
據(jù)FDA官網(wǎng)顯示,Zurzuvae曾獲得快速通道、突破療法和優(yōu)先審批資質(zhì)。
產(chǎn)后支持國(guó)際執(zhí)行主任Wendy N. Davis博士說(shuō):“今天的批準(zhǔn)對(duì)于美國(guó)估計(jì)有500萬(wàn)名婦女來(lái)說(shuō)是個(gè)好消息,她們每年報(bào)告經(jīng)歷這種破壞性且經(jīng)常被誤解的疾病的癥狀。患有PPD的女性迫切需要及時(shí)的護(hù)理和額外的治療選擇,以提供快速緩解,以便她們能夠在生命中的這個(gè)重要時(shí)刻保持健康和存在。”
? 助力致根醫(yī)藥新型抗抑郁藥物ZG-001獲準(zhǔn)開(kāi)展臨床
2023年9月6日,Wave Life Sciences宣布遞交其在研療法WVE-006的首個(gè)臨床試驗(yàn)申請(qǐng),用以治療α-1抗胰蛋白酶缺乏癥(AATD)。
WVE-006為一款經(jīng)PN化學(xué)修飾、GalNAc偶聯(lián)、潛在“first-in-class”的AATD在研寡核苷酸療法,也是是首款進(jìn)入臨床開(kāi)發(fā)的RNA編輯療法。
AATD是一種遺傳性疾病,通常由SERPINA1基因中的G-A點(diǎn)突變(Z等位基因)引起。這種突變會(huì)導(dǎo)致肺部缺乏野生型α-1抗胰蛋白酶(M-AAT)功能,從而引發(fā)肺部疾病;同時(shí),Z-AAT蛋白在肝細(xì)胞中錯(cuò)誤折疊聚集,從而引發(fā)肝臟疾病。通過(guò)輸送AAT蛋白進(jìn)行增強(qiáng)治療是目前治療AATD肺病的唯一方法,需要每周進(jìn)行一次靜脈注射;而除肝移植外,目前還沒(méi)有其他治療方法解決AATD肝臟疾病。WVE-006旨在修正突變的SERPINA1基因的轉(zhuǎn)錄物,以改善此疾病在肝臟與肺臟的病征。
? bDNA技術(shù)在寡核苷酸及mRNA藥物生物分析中的應(yīng)用與實(shí)例分享
1
2023年9月6日,Wave Life Sciences宣布遞交其在研療法WVE-006的首個(gè)臨床試驗(yàn)申請(qǐng),用以治療α-1抗胰蛋白酶缺乏癥(AATD)。
2023年10月2日,匈牙利-美國(guó)生物學(xué)家卡塔林·考里科 (Katalin Karikó) 和美國(guó)生物學(xué)家德魯·韋斯曼(Drew Weissman)因在核苷堿基修飾方面的發(fā)現(xiàn),使得開(kāi)發(fā)針對(duì)COVID-19的有效mRNA疫苗成為可能,獲得2023年諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)。
2023年10月9日,百時(shí)美施貴寶(BMS)宣布以每股58.00美元現(xiàn)金收購(gòu)Mirati Therapeutics,總股本價(jià)值為48億美元。
對(duì)BMS而言,這次收購(gòu)補(bǔ)充了其腫瘤領(lǐng)域管線儲(chǔ)備;對(duì)Mirati而言,能夠加快KRAS抑制劑Krazati的商業(yè)化和推進(jìn)其它候選藥物的開(kāi)發(fā)。
芝加哥大學(xué)醫(yī)學(xué)院教授Marina C. Garassino表示:“迄今為止展現(xiàn)出的數(shù)據(jù)表明,在免疫療法之后或與免疫療法聯(lián)合使用Adagrasib,為KRAS G12C突變的一線NSCLC患者提供了安全可耐受的方案。Adagrasib是唯一一種可在免疫治療同時(shí)或之后聯(lián)合使用的KRAS G12C抑制劑,肝毒性得到了良好管理,并且仍然表現(xiàn)出積極的療效信號(hào)。”
? 10月29日,君實(shí)生物的抗腫瘤免疫療法PD-1抑制劑特瑞普利單抗已獲得FDA批準(zhǔn)上市,成為首個(gè)獲FDA批準(zhǔn)上市的中國(guó)抗PD-1單抗。
此后12月1日,君實(shí)生物宣布澳大利亞藥品管理局(TGA)已受理特瑞普利單抗的上市許可申請(qǐng),針對(duì)適應(yīng)癥為聯(lián)合順鉑/吉西他濱作為轉(zhuǎn)移性或復(fù)發(fā)性局部晚期鼻咽癌成人患者的一線治療,以及作為單藥治療既往含鉑治療過(guò)程中或治療后疾病進(jìn)展的復(fù)發(fā)性、不可切除或轉(zhuǎn)移性鼻咽癌的成人患者。
? 11月8日,和黃醫(yī)藥自主研發(fā)的抗腫瘤新藥呋喹替尼獲得FDA批準(zhǔn)上市,進(jìn)入當(dāng)?shù)蒯t(yī)藥市場(chǎng),以治療晚期結(jié)直腸癌。這是美國(guó)首個(gè)且唯一獲批用于治療經(jīng)治轉(zhuǎn)移性結(jié)直腸癌的,針對(duì)全部三種抗血管內(nèi)皮生長(zhǎng)因子(VEGF)受體的高選擇性抑制劑。
? 11月18日,億帆醫(yī)藥的第三代白細(xì)胞生長(zhǎng)因子艾貝格司亭α注射液獲得FDA批準(zhǔn)上市,用于成年非髓性惡性腫瘤患者在接受容易引起發(fā)熱性中性粒細(xì)胞減少癥的骨髓抑制性抗癌藥物治療時(shí),降低以發(fā)熱性中性粒細(xì)胞減少癥為表現(xiàn)的感染發(fā)生率。
2023年12月8日,美國(guó)FDA批準(zhǔn)了首款基于新型基因編輯技術(shù)的基因療法——Casgevy,為12歲及以上鐮刀型細(xì)胞貧血癥(SCD)患者帶來(lái)基因療法的新選擇。
Casgevy,由CRISPR與Vertex共同研發(fā),利用CRISPR/Cas9基因編輯系統(tǒng),在體外對(duì)來(lái)自患者的造血干細(xì)胞進(jìn)行編輯,使血紅細(xì)胞生產(chǎn)高水平的胎兒血紅蛋白(HbF)。此前已獲得英國(guó)藥品和健康產(chǎn)品管理局(MHRA)上市許可。
僅11年,這項(xiàng)突破性技術(shù)走向臨床應(yīng)用。
2012年,CRISPR-Cas9作為編輯基因工具迎來(lái)它的首個(gè)高光時(shí)刻:用于修改基因組靶區(qū)序列;
2015年,鑒于其在基因編輯方面的革命性潛力,《科學(xué)》雜志在將CRISPR評(píng)為年度突破;
2020年,這一發(fā)現(xiàn)為Emmanuelle Charpentier和Jennifer Doudna贏得了諾貝爾化學(xué)獎(jiǎng);
2023年,CRISPR基因編輯療法Casgevy獲批。
這是一次里程碑意義的批準(zhǔn),推開(kāi)CRISPR療法在未來(lái)進(jìn)一步轉(zhuǎn)化與臨床應(yīng)用的大門,為遺傳性疾病治療帶來(lái)更多治愈的機(jī)會(huì)。
 相關(guān)新聞
相關(guān)新聞