



業(yè)務(wù)咨詢
中國(guó):
Email: marketing@medicilon.com.cn
業(yè)務(wù)咨詢專線:400-780-8018
(僅限服務(wù)咨詢,其他事宜請(qǐng)撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




播種有時(shí)、成長(zhǎng)有時(shí)、收獲有時(shí)。對(duì)于生物醫(yī)藥行業(yè)來(lái)說(shuō),亦如此。在持續(xù)多年的政策與資本支持的滋潤(rùn)下,中國(guó)生物醫(yī)藥行業(yè)創(chuàng)新能力量汲取到了成長(zhǎng)養(yǎng)分,在抗體、ADC、PROTAC、CGT療法等新興領(lǐng)域厚積薄發(fā),與海外藥企的代際差距逐漸消弭,有了全球頂尖制藥企業(yè)平坐掰手腕的力量。這股力量驅(qū)動(dòng)創(chuàng)新藥命運(yùn)的齒輪,從悄然轉(zhuǎn)動(dòng)到加速狂飆!
時(shí)下創(chuàng)新藥研發(fā)深陷同質(zhì)化內(nèi)卷,出海無(wú)疑成為創(chuàng)新藥企抓住機(jī)遇、擺脫困境的必選項(xiàng)。中國(guó)創(chuàng)新藥發(fā)展迎來(lái)空前大爆發(fā),出海潮來(lái)勢(shì)洶洶,不僅接連成功闖關(guān)FDA,對(duì)外授權(quán)合作規(guī)模也再創(chuàng)新高。
造船出海
中美雙報(bào)已成大勢(shì)所趨
眾所周知,美國(guó)是全球最大的醫(yī)藥市場(chǎng),F(xiàn)DA也擁有全球最完善、最嚴(yán)格的藥品審評(píng)體系。獲得FDA的批準(zhǔn),意味著這款藥大概率能順利通過(guò)全球其他40多個(gè)地區(qū)的審批,基本獲得了全球醫(yī)藥市場(chǎng)的準(zhǔn)入門票。隨著中國(guó)加入ICH,中美雙報(bào)正逐漸成為中國(guó)藥企全球化布局與發(fā)展的一種新趨勢(shì)。越來(lái)越多企業(yè)目光逐漸轉(zhuǎn)向出海,越來(lái)越多企業(yè)開(kāi)展中美雙報(bào),開(kāi)啟造船出海之旅。
據(jù)統(tǒng)計(jì),2023年FDA批準(zhǔn)的新藥總數(shù)達(dá)到66款(其中包括55個(gè)藥物和11個(gè)疫苗、生物制劑),遠(yuǎn)超2022年,創(chuàng)下五年新高。同時(shí),獲批新藥適應(yīng)癥呈現(xiàn)出百花齊放趨勢(shì),其中罕見(jiàn)病和腫瘤仍是重點(diǎn)領(lǐng)域,取得令人矚目的成績(jī)。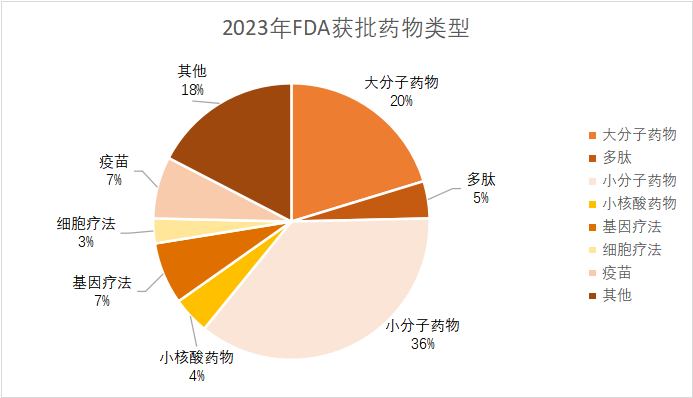
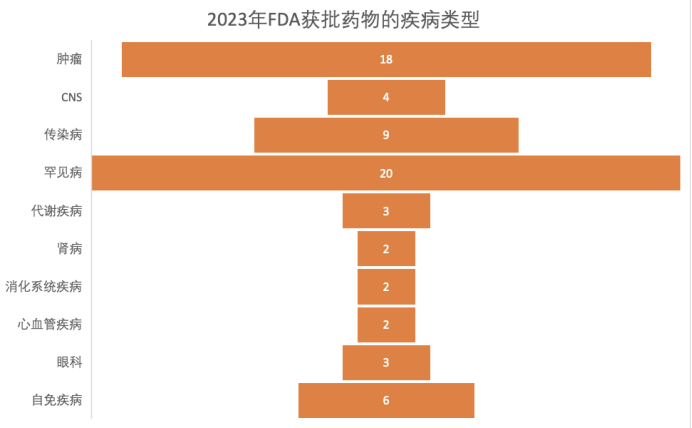
圖片來(lái)源于 動(dòng)脈網(wǎng)
作為中國(guó)較早提供整套同時(shí)符合中國(guó)GLP和美國(guó)GLP標(biāo)準(zhǔn)的新藥臨床研究申報(bào)的CRO公司之一,美迪西有幸參與了宇耀生物和標(biāo)新生物的臨床前研發(fā)。加速了其研發(fā)進(jìn)程。
美迪西現(xiàn)擁有2.9萬(wàn)㎡實(shí)驗(yàn)室獲得NMPA藥物GLP實(shí)驗(yàn)室資質(zhì),符合美國(guó)FDA, 澳洲TGA,歐盟 EMEA 的GLP實(shí)驗(yàn)室標(biāo)準(zhǔn),擁有完整的化學(xué)發(fā)現(xiàn),藥學(xué)研究全程的標(biāo)準(zhǔn)服務(wù)。據(jù)不完全統(tǒng)計(jì),僅在2023年,美迪西參與研發(fā)完成新藥及仿制藥項(xiàng)目已有總共約90件通過(guò)中國(guó)NMPA及美國(guó)FDA的審批進(jìn)入臨床試驗(yàn)。美迪西注冊(cè)事務(wù)服務(wù)平臺(tái)深入了解中國(guó)、美國(guó)、澳洲和歐盟等國(guó)家和地區(qū)的注冊(cè)法規(guī)政策以及其對(duì)藥物的技術(shù)要求,能為國(guó)內(nèi)外的客戶提供藥品開(kāi)發(fā)和注冊(cè)策略咨詢以及基于NMPA和FDA的新藥臨床試驗(yàn)(IND),仿制藥上市申請(qǐng)(ANDA)申報(bào)資料的編制報(bào)批服務(wù)。同時(shí)擁有專業(yè)的IND、ANDA技術(shù)研究團(tuán)隊(duì),可提供一站式的臨床前研究、全程項(xiàng)目管理以及注冊(cè)服務(wù),已積累了豐富的中美雙報(bào)項(xiàng)目實(shí)戰(zhàn)經(jīng)驗(yàn)。
借船出海
License out開(kāi)啟狂飆新時(shí)代
新藥IND申請(qǐng)獲美國(guó)FDA批準(zhǔn)是獲得創(chuàng)新藥出海的入場(chǎng)券,要想真正登上國(guó)際舞臺(tái),藥企還要應(yīng)對(duì)在海外開(kāi)展臨床翻倍的成本、陌生的商業(yè)化環(huán)境等重重挑戰(zhàn)。面對(duì)再大的海外“蛋糕”,有些藥企也只能望洋興嘆。而License out交易模式,不僅可以快速回籠資金、補(bǔ)充研發(fā),還可以借助海外藥企的各種資源,實(shí)現(xiàn)優(yōu)勢(shì)互補(bǔ)、降低新藥研發(fā)風(fēng)險(xiǎn),快速進(jìn)入國(guó)際市場(chǎng)、獲得豐厚現(xiàn)金流。
因此,門檻更低、風(fēng)險(xiǎn)更小、更成熟的License-out模式成為中國(guó)創(chuàng)新藥企業(yè)的替代之選。
風(fēng)云際會(huì),與造船一樣,借船出海同樣迎來(lái)發(fā)展黃金期。據(jù)不完全統(tǒng)計(jì),截至2023年12月21日,2023年國(guó)內(nèi)共發(fā)生了近70筆創(chuàng)新藥License-out交易,已披露交易總金額超350億美元。這一數(shù)據(jù)已經(jīng)遠(yuǎn)超去年,據(jù)康橙投資數(shù)據(jù),2022年,中國(guó)創(chuàng)新藥License-out交易發(fā)生了44起,披露的交易金額約275.50億美元。
截至目前,美迪西已成功助力多款創(chuàng)新藥物成功出海,也持續(xù)關(guān)注新興醫(yī)藥企業(yè)的出海戰(zhàn)略和商業(yè)化落地。推動(dòng)加速合作伙伴的臨床前開(kāi)發(fā),助力創(chuàng)新藥企擴(kuò)展全球化版圖,美迪西使命必達(dá)。
打鐵還需自身硬,無(wú)論是造船出海,還是借船出海,解決產(chǎn)品同質(zhì)化、創(chuàng)新差異化、提高研發(fā)效率等問(wèn)題,做真正的創(chuàng)新藥才能打贏出海攻堅(jiān)戰(zhàn),劈波斬浪直抵彼岸。
乘風(fēng)出海任重道遠(yuǎn)
看美迪西如何助力創(chuàng)新藥企揚(yáng)帆出海?
產(chǎn)品:如何打造差異化競(jìng)爭(zhēng)優(yōu)勢(shì)?
隨著創(chuàng)新藥企及管線越來(lái)越多,創(chuàng)新藥靶點(diǎn)類似,很容易在擁擠、熱門的賽道中獲得一席之地。如何打造差異化競(jìng)爭(zhēng)優(yōu)勢(shì)是核心問(wèn)題。
美迪西依托智能靶點(diǎn)和AI虛擬藥物發(fā)現(xiàn)平臺(tái),有著開(kāi)發(fā)并驗(yàn)證針對(duì)不同靶點(diǎn)分析方法的豐富經(jīng)驗(yàn),能夠有效根據(jù)需求分析靶點(diǎn)的表達(dá)水平、以及靶點(diǎn)可及性,為靶點(diǎn)的選擇提供建設(shè)性意見(jiàn)。如在ADC領(lǐng)域,已助力完成針對(duì)Her2、Her3、Trop2、Claudin 18.2、CD33、Muc1、FR等靶點(diǎn)藥物的開(kāi)發(fā);在KRAS、STAT3、GLP-1R等新興靶向藥等均有搭建一站式臨床前研發(fā)服務(wù)平臺(tái),賦能藥物在賽道上加速跑。
融資:如何突破新藥研發(fā)資金瓶頸?
據(jù)動(dòng)脈橙產(chǎn)業(yè)智庫(kù)統(tǒng)計(jì),2023年前三季度,中國(guó)共計(jì)發(fā)生128件融資事件,同比下降24%;融資額度上,為總額361.74億元,同比下降54%。生物醫(yī)藥領(lǐng)域的投融資環(huán)境明顯趨緊。融資是橫在藥物研發(fā)路上的難題。
為打造了一個(gè)全新的投融助力平臺(tái),為新藥的研發(fā)、試驗(yàn)、上市等各個(gè)環(huán)節(jié)提供穩(wěn)定的資金支持,美迪西院士創(chuàng)新藥熟化中心與多家金融機(jī)構(gòu)合作,搭建新藥投融助力平臺(tái),旨在為新藥研發(fā)提供資金支持。
研發(fā):助力高質(zhì)效推進(jìn)藥物研發(fā)進(jìn)程
據(jù)畢馬威的數(shù)據(jù)統(tǒng)計(jì),對(duì)于藥效不變的前提下,首次上市的藥物市占率達(dá)約65%,其次約占25%,后來(lái)者市場(chǎng)占率較微乎其微。所以,出海是一場(chǎng)時(shí)間上的攻堅(jiān)戰(zhàn),速度是非常重要的考量因素。
美迪西一家專業(yè)的生物醫(yī)藥臨床前綜合研發(fā)服務(wù)CRO,為全球的醫(yī)藥企業(yè)和科研機(jī)構(gòu)提供全方位的符合國(guó)內(nèi)及國(guó)際申報(bào)標(biāo)準(zhǔn)的一站式新藥研發(fā)服務(wù),服務(wù)涵蓋醫(yī)藥臨床前新藥研究的全過(guò)程,主要包括藥物發(fā)現(xiàn)、藥學(xué)研究、臨床前研究及IND申報(bào)。至2023年底,美迪西已為全球超2000家客戶提供藥物研發(fā)服務(wù),參與研發(fā)完成的新藥及仿制藥項(xiàng)目已有420件IND獲批臨床。
交易:助力創(chuàng)新藥階段性成果交易
實(shí)現(xiàn)License out,需要非常嚴(yán)謹(jǐn)和完善的BD業(yè)務(wù)對(duì)接機(jī)制。根據(jù)媒體公開(kāi)報(bào)道,不完全統(tǒng)計(jì),2023年前三季度全球藥企之間“退貨”已達(dá)15例,其中國(guó)內(nèi)藥企出海遇阻案例已達(dá)8例。在浪潮下,“退貨”事件提醒著我們不能盲目樂(lè)觀。
為了助力新藥研發(fā)階段性成果的轉(zhuǎn)化和交易,美迪西院士創(chuàng)新藥熟化中心建立了公開(kāi)、透明的新藥研發(fā)交易平臺(tái),鼓勵(lì)更多的科研人員投入到新藥的研發(fā)中,助力科研成果得到更好的展現(xiàn)和回報(bào)。
好藥無(wú)國(guó)界,就應(yīng)去往更廣袤的天地!成功造船出海或借船出海,無(wú)疑充分證明中國(guó)藥企的創(chuàng)新研發(fā)能力得到了國(guó)際市場(chǎng)的認(rèn)可。美迪西將通過(guò)不斷完善一站式生物醫(yī)藥臨床前研發(fā)服務(wù)平臺(tái),為創(chuàng)新藥企業(yè)出海護(hù)航,助力更多的創(chuàng)新藥叩開(kāi)美國(guó)FDA大門,叩響生物醫(yī)藥國(guó)際舞臺(tái)的大門!
美迪西助力 | 宇耀生物STAT3雙磷酸化位點(diǎn)抑制劑YY201成功完成中美雙報(bào)
美迪西助力 | 標(biāo)新生物第二個(gè)分子膠管線GT929實(shí)現(xiàn)中美雙報(bào)雙批
美迪西助力 | 盛世泰科1類創(chuàng)新藥物CGT-9475實(shí)現(xiàn)中美雙報(bào)雙批
美迪西助力 | 標(biāo)新生物首個(gè)分子膠降解劑管線GT919新藥臨床研究申請(qǐng)獲FDA批準(zhǔn)
美迪西助力 | 全球獨(dú)創(chuàng),開(kāi)悅生命針對(duì)RNA解旋酶的小分子新藥獲FDA臨床實(shí)驗(yàn)許可(IND)
美迪西助力 | 質(zhì)肽生物ZT002中、美、澳三報(bào)
美迪西助力 | 國(guó)內(nèi)首個(gè)CD19×CD3×CD28三特異性抗體獲FDA默示許可
美迪西助力 | 華奧泰靶向CD73的ADC在美國(guó)獲批臨床
美迪西助力 | 璧辰醫(yī)藥ABM-1310獲美國(guó)FDA孤兒藥資格認(rèn)證
美迪西助力 | 百明信康首創(chuàng)格雷夫斯癥(Graves)新型特異性免疫療法獲FDA臨床許可
美迪西助力 | 寶太生物首個(gè)自主研發(fā)新藥BIOT-001 IND申請(qǐng)獲FDA批準(zhǔn)
美迪西助力 | 邏晟生物首款新藥NB002 IND申請(qǐng)獲FDA臨床許可
美迪西助力 | 拓領(lǐng)博泰1.1類新藥TollB-001片正式獲FDA臨床批準(zhǔn)
美迪西助力 | 銳格醫(yī)藥新一代腫瘤靶向抑制劑RGT-419B臨床試驗(yàn)申請(qǐng)獲得美國(guó)FDA默示許可
 相關(guān)新聞
相關(guān)新聞